重炭酸イオンを感知するGタンパク質共役型受容体の発見
― 脳梗塞治療への応用の可能性 ―
重炭酸イオンは、炭酸・重炭酸緩衝系(*2)を構成して生体内の酸塩基平衡を担っています。酸塩基平衡による細胞の挙動の変化は、これまで主にプロトン濃度で規定されるpHの変化によって説明されてきましたが、近年、CO2や重炭酸イオンの関与も示唆されるようになりました。研究グループは、Gタンパク質共役型受容体であるGPR30がpH非依存的に重炭酸イオンによって細胞内カルシウムを上昇させることを発見しました。さらに、GPR30が脳微小血管壁細胞(*3)(ペリサイト(*4))に発現し、血流を制御して虚血再灌流障害(*5)に関与することを明らかにしました。
本成果は、酸塩基平衡による細胞機能制御の新たな側面を明らかにするとともに、新たな脳梗塞治療への応用の可能性を示すものです。
本論文はSpringer Natureの学術誌であるNature Communications誌に2024年2月27日付(ロンドン時間)で公開されました。
■本研究成果のポイント
GPR30が重炭酸イオンによって活性化し細胞内カルシウムを上昇させることを発見
GPR30が脳微小血管に発現し、血流の回復を制御して虚血再灌流障害に関与することを解明
GPR30の活性化制御が新たな脳梗塞治療法の開発へつながる可能性を見いだした
■背景
炭酸・重炭酸緩衝系をはじめとする複数の緩衝系によって、生体内環境はpH 7.4付近に一定に保たれています(pH恒常性)。しかし、胃酸分泌細胞周囲や腫瘍組織内部、虚血部位や再灌流部位など、局所的には大きなpHやイオン濃度の変化があります。これまで、水素イオン(プロトン)を感知するGタンパク質共役型受容体(GPCR)が研究グループをはじめとする複数のグループによって見いだされ、プロトン濃度の上昇(pHの低下)が細胞応答を引き起こすことが知られていました。一方、近年、重炭酸イオンや二酸化炭素も細胞応答を引き起こすことがわかり、これらを認識する受容体の存在が示唆されていました。また、酸塩基平衡の異常がpH変化とは異なるメカニズムで虚血再灌流障害に関与することも示唆されていました。以上より研究グループは、酸塩基平衡の変化に応答する新規のシグナル伝達経路があるのではないかと考え、353個のGPCRの各組織での発現量のパブリックデータベースと脳微小血管構成細胞の一細胞RNAシーケンスのデータベースの解析から、酸塩基平衡に関与するGPCR候補を探しました。
■内容
本研究では、GPCRの組織発現量および脳微小血管の一細胞RNAシーケンスのパブリックデータベースを用い、酸塩基平衡に関連するGPCR候補としてGPR30に着目しました。GPR30は膜型エストロゲン受容体として報告されていますが、研究グループの実験ではエストラジオールやタモキシフェンといった既に報告されていたリガンドへの反応は認められませんでした。しかし研究グループは、細胞培養培地の添加によって細胞内カルシウムが上昇することを偶然発見し、培地中の各成分を添加してGPR30の応答を解析することで、GPR30が培地中の重炭酸イオンに応答していることを突き止めました(図1)。
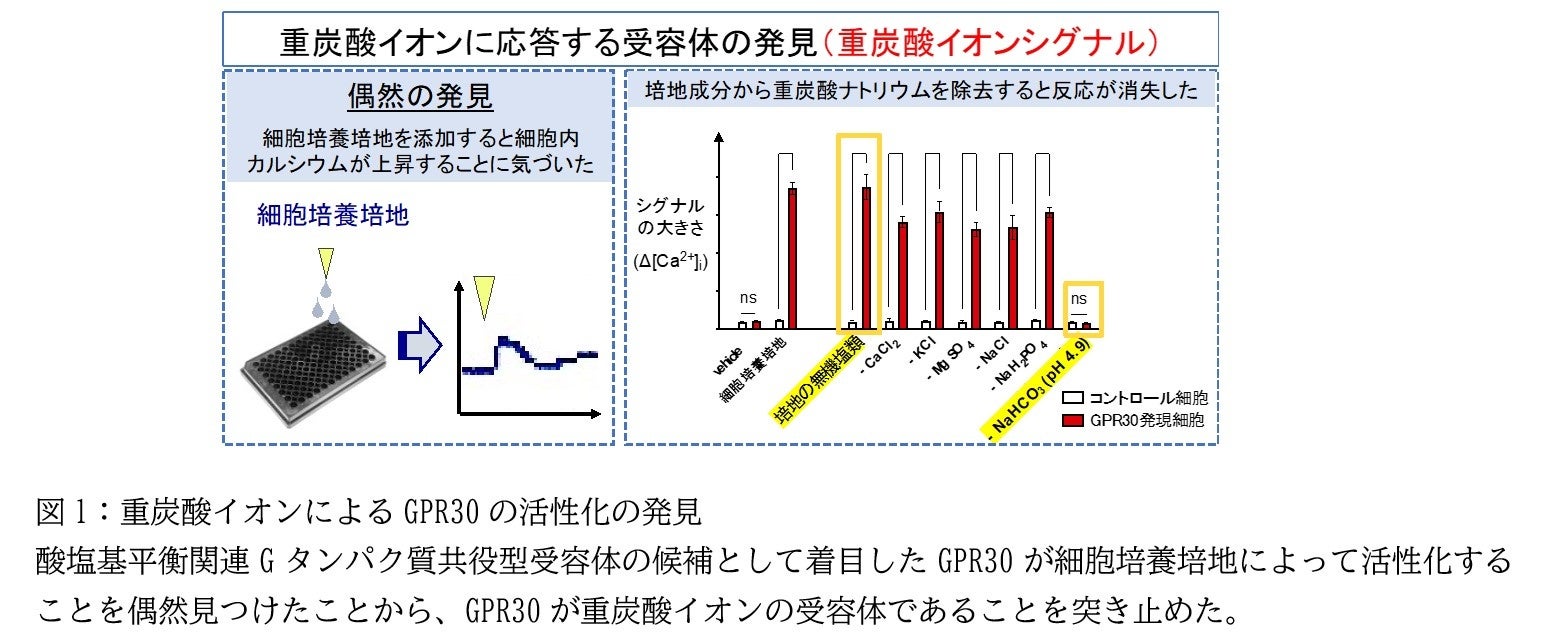
次に研究グループは、GPR30発現細胞で蛍光タンパク質を発現するマウスを作製して全身の臓器を調べ、GPR30が脳の血管壁細胞に発現していることを見出しました(図2A)。さらに、このマウスから単離したペリサイトおよび血管平滑筋細胞が、GPR30依存的に重炭酸ナトリウムに反応して細胞内カルシウムを上昇させることを証明しました(図2B)。
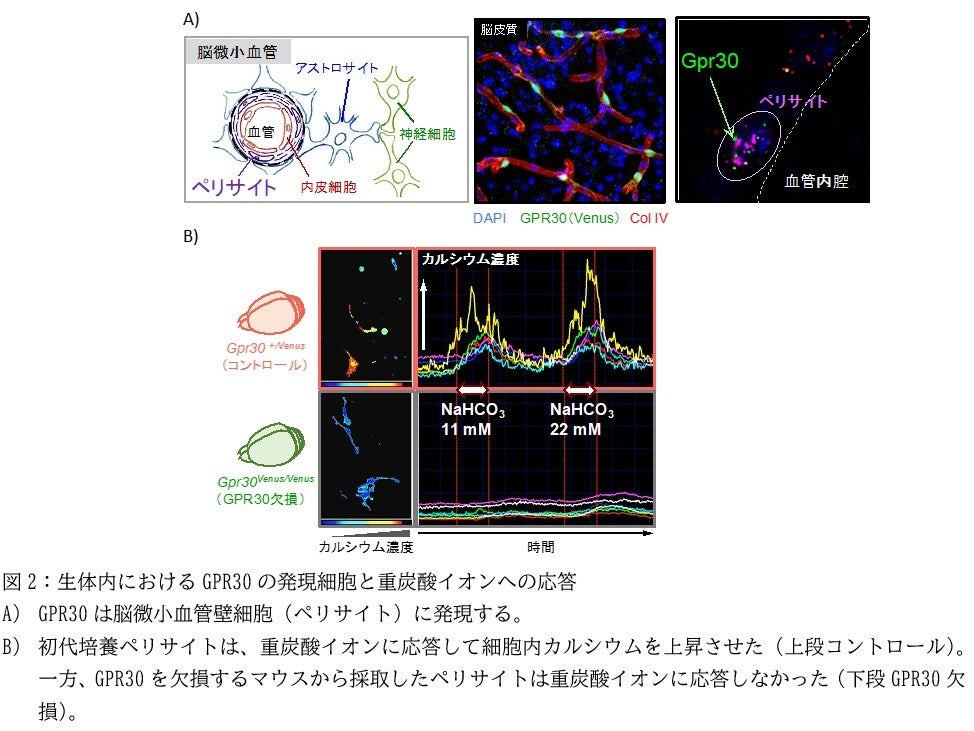
ペリサイトは血液脳関門(BBB)(*6)の維持や血流の調節に関わっていることが知られています。また、脳梗塞の中心的な病態である虚血再灌流障害に関与していることも知られています。そこで、GPR30欠損マウスを作製して一過性局所脳虚血モデル(中大脳動脈閉塞モデル、MCAO)(*7)を作ると、GPR30の欠損により虚血再灌流障害が軽減することがわかりました(図3)。さらに、GPR30欠損マウスでは、中大脳動脈の再開通後の脳血流の回復が速やかに生じることも明らかになりました。
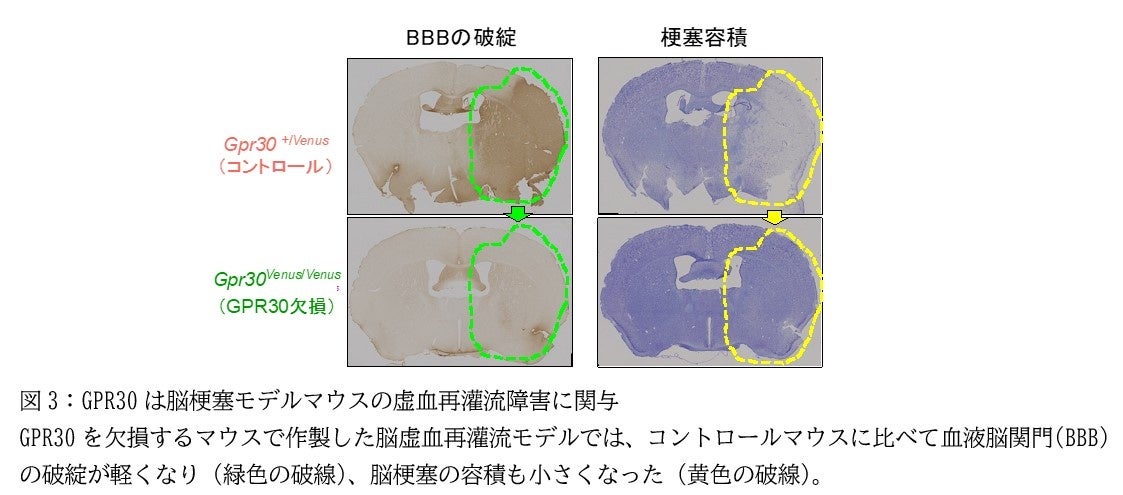
以上の結果から、GPR30は血管壁に存在する重炭酸イオン受容体であることが明らかになりました。さらに、GPR30は血流をコントロールし、虚血再灌流障害に関与することが明らかになりました。
■今後の展開
今回、研究グループは世界に先駆けて重炭酸イオン受容体を発見しました。既に発見しているプロトン受容体と合わせ、酸塩基平衡はGPCRの活性化を介して細胞応答を引き起こす可能性が示唆されます。さらに、GPR30が脳主幹動脈再開通後の微小循環障害に関与している可能性が明らかになったことから、GPR30は脳梗塞の新規治療ターゲットとなる可能性が期待されます。
■用語解説
*1 Gタンパク質共役型受容体(GPCR):
真核細胞の細胞質膜上あるいは細胞内部の構成膜上に存在する受容体の一種。7回膜貫通型受容体とも呼ばれる。神経伝達物質やホルモン、化学物質などのさまざまな刺激を受容して構造変化を起こし、細胞内部で結合している三量体Gタンパク質あるいはβアレスチンを介して、更に下流のシグナルを活性化することで、細胞外の情報が細胞内へと伝達される。
*2 炭酸・重炭酸緩衝系:
生体内の酸塩基平衡を維持する主要な機構。H2O + CO2 ⇔ H2CO3 ⇔ [H+] + [HCO3-]
*3 血管壁細胞:
血管内皮細胞を取り囲むように存在する細胞。血管構造の維持や血流の調節に関与している。ペリサイトと血管平滑筋細胞に大別される。
*4 ペリサイト:
毛細血管から細小血管のレベルにおいて、内皮細胞を囲む基底膜に埋もれた形で存在する血管壁細胞。他の組織に比べて脳では内皮細胞に対する存在比率が高い。内皮細胞やアストロサイトとの相互作用により、血液脳関門の維持や脳血流の制御に重要な役割を果たしている。
*5 虚血再灌流障害:
虚血状態にある組織に血流が再開した際に引き起こされる、微小循環障害を起因とする組織障害。脳梗塞や心筋虚血、急性腎不全などで見られる。カテーテル治療などによる組織再灌流時の合併症の一つでもある。
*6 血液脳関門(BBB):
血液と脳組織の間の物質のやり取りを制御する機構。血管内皮細胞、ペリサイト、アストロサイトなどの協調的な働きによって、脳の内部環境が維持されている。
*7 一過性局所脳虚血モデル(中大脳動脈閉塞モデル、MCAO):
代表的な脳梗塞モデル。血管内に挿入した塞栓糸によって中大脳動脈の起始部を一時的に閉塞し、中大脳動脈支配領域に虚血を引き起こす。一定時間経過後に塞栓糸を引き抜いて中大脳動脈を再開通させると、その支配領域の血流が回復する。
■研究者のコメント
自身の思いがけない実験結果から始まり、その後の10年を費やした研究がようやく形になり感慨深いです。長い時間がかかりましたが、本研究を進めるうちに今後の課題も見えてきました。今回の研究成果にとどまらず、さらに重炭酸イオン受容体の世界を広げられるよう、より一層精進したいと思います。
本研究成果の背景には、多くの方々の協力による沢山の探索的な実験がありました。その段階で関わって下さった方々にも、心よりの感謝を申し上げます。 城(渡辺) 愛理
■原著論文
本研究はSpringer Natureの学術誌であるNature Communications誌に2024年2月27日付(ロンドン時間)で公開されました。
タイトル:Bicarbonate signalling via G protein-coupled receptor regulates ischaemia-reperfusion injury.
タイトル(日本語訳):重炭酸イオンはGタンパク質共役型受容体を介して虚血再灌流障害を制御する
著者:Airi Jo-Watanabe1, 2)(筆頭著者、責任著者), Toshiki Inaba3), Takahiro Osada4), Ryota Hashimoto5), Tomohiro Nishizawa6), Toshiaki Okuno1), Sayoko Ihara7), Kazushige Touhara7), Nobutaka Hattori3, 8), Masatsugu Oh-Hora1, 5), Osamu Nureki9), and Takehiko Yokomizo1)(共同責任著者)
著者(日本語表記):城(渡辺)愛理1, 2)、稲葉俊東3)、長田貴宏4)、橋本良太5)、西澤知宏6)、奥野利明1)、伊原さよ子7)、東原和成7)、服部信孝3, 8)、大洞将嗣1, 5)、濡木理9)、横溝岳彦1)
筆者所属:1)順天堂大学大学院医学研究科生化学・細胞機能制御学、2)AMED-PRIME、3) 順天堂大学大学院医学研究科神経学、4)同 神経生理学、5)同 細胞機能研究室、6)横浜市立大学大学院生命医科学研究科、7) 東京大学大学院農学生命科学研究科、8) 理化学研究所脳神経科学研究センター神経変性疾患連携研究チーム、9) 東京大学大学院理学系研究科
DOI: 10.1038/s41467-024-45579-3.
本研究はJSPS科研費JP18K15051, JP20K16148, JP18H02627, JP19KK0199, 21H04798, および日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(PRIME)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「重炭酸イオンがシグナル伝達分子として引き起こす時空間作用 — 脳内微小環境(NVU)の修復機構の解明」(研究開発代表者:城(渡辺) 愛理)JP20gm6210026の支援を受け、多施設との共同研究の基に実施されました。
本研究を進めるにあたり、多数の方にご助言・ご協力いただいきました。ここに深謝いたします。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
