α2マクログロブリンが変性タンパク質を分解する役割を発見
~アルツハイマー病などの新しい治療法確立に前進~
千葉大学大学院理学研究院の板倉英祐准教授らの研究グループは、血液中に豊富に存在するタンパク質であり、プロテアーゼインヒビター(タンパク質分解阻害剤)として働くことが知られているα2マクログロブリン(注1)が、血液中の変性タンパク質を細胞内へ運び、分解へ導くことを明らかにしました(概略図)。
この研究成果は、英国科学雑誌Scientific Reportsで3月28日(英国時間)に公開されます。
この研究成果は、英国科学雑誌Scientific Reportsで3月28日(英国時間)に公開されます。
- 研究の背景
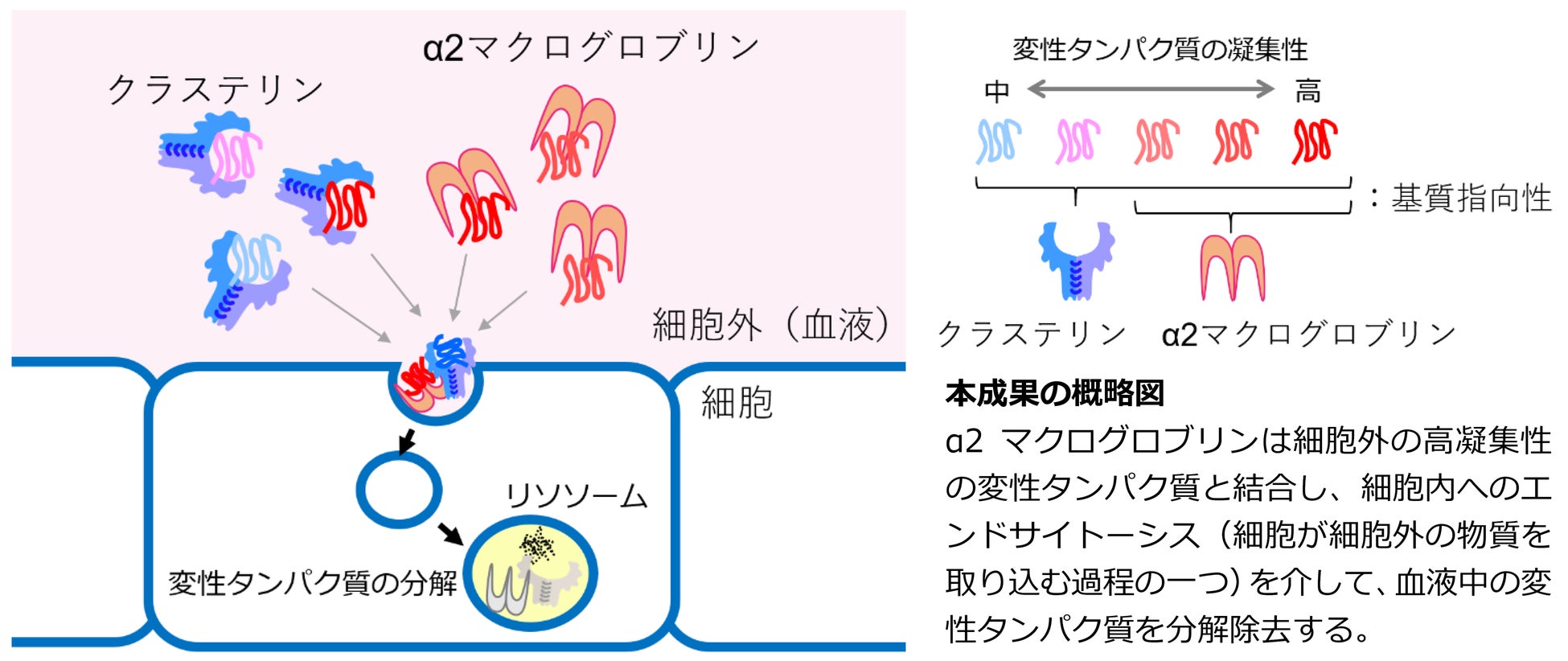
- 研究の成果
本研究グループは以前の研究でも、別の細胞外シャペロンであるクラステリン(注6)が細胞外変性タンパク質をリソソーム分解へ導くことを明らかにしていました(下記関連研究参照)。そこでα2マクログロブリンとクラステリンの基質指向性(注7)の違いを調べたところ、α2マクログロブリンはより凝集性の高い変性タンパク質への指向性が高いのに対して、クラステリンは広範な変性タンパク質に指向性があることがわかりました。細胞外変性タンパク質を認識する細胞外シャペロンの基質指向性の違いを使い分けることで、特定の基質を標的とした分解システムの応用が期待されます。
- 研究者のコメント(千葉大学大学院理学研究院 板倉英祐准教授)
- 用語解説
(注2)アルツハイマー病:アルツハイマー病は最も多い認知症であり、世界で5000万人強の患者がいます。アミロイドβという変性タンパク質が脳内に蓄積することが、原因の一つとして考えられています。
(注3)リソソーム:タンパク質分解酵素を含む細胞小器官の一つであり、不要なタンパク質を分解する場として働きます。
(注4)取込みアッセイ法:蛍光を付加した細胞外タンパク質を細胞が取込み、リソソームに蓄積した蛍光タンパク質量をフローサイトメーター(自動細胞解析分離装置)によって定量解析する手法。
(注5)シャペロン:折りたたみが不完全なタンパク質に結合し、その凝集体化を抑制するタンパク質。
(注6)クラステリン:細胞外環境の異常タンパク質をリソソーム分解へ導く細胞外シャペロンのひとつ。
(注7)基質指向性:タンパク質が特定のタンパク質(基質)に結合する際の選択性。
- 研究プロジェクトについて
【科学技術振興機構(JST)】
創発的研究支援事業 JPMJFR204N
【日本学術振興会(JSPS)】
基盤研究(B) 20H03249
新学術領域研究(研究領域提案型) 20H05312、22H04634
- 論文情報
掲載誌名:Scientific Reports
著者:Ayaka Tomihari, Mako Kiyota, Akira Matsuura, Eisuke Itakura
DOI:https://doi.org/10.1038/s41598-023-31104-x
- 関連研究
https://www.s.chiba-u.ac.jp/pr/files/itakura20200219.pdf
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
