精神的ストレスがアトピー性皮膚炎を悪化させるメカニズムを解明
― ストレスは免疫細胞を狂わせる! ―


順天堂大学大学院医学研究科 環境医学研究所の吉川宗一郎 准教授、冨永光俊 先任准教授、髙森建二 特任教授、順天堂大学医学研究科 免疫学の三宅幸子 教授ら、および岡山大学大学院医歯薬学総合研究科の浦上仁志 大学院生、同大学術研究院医歯薬学域(医)の森実真 教授らの共同研究グループは東京科学大学、長崎大学、鳥取大学との共同研究により、精神的ストレスが皮膚アレルギーを悪化させるメカニズムを解明しました。ストレスは古くからアレルギーのリスクファクターであることが知られていたものの、その分子メカニズムは長らく不明でしたが、本研究により交感神経(*1)由来のストレスホルモンが抗炎症性マクロファージ(*2)(免疫細胞の一種)のβ2アドレナリン受容体(*3)を介して抗炎症機能を低下させ、炎症を悪化させていることを突き止めました。本成果は、従来、治療が困難であったストレス性の皮膚アレルギー炎症に対し、新規治療薬開発の可能性を示すものです。本論文はJournal of Allergy and Clinical Immunology誌に、2024年11月18日にオンライン版で発表されました。
本研究成果のポイント
-
精神的ストレスによる皮膚アレルギーの悪化には交感神経と抗炎症性マクロファージのβ2アドレナリン受容体(Adrb2)が関与することを明らかにしました。
-
抗炎症性マクロファージのAdrb2にストレスホルモンが作用すると抗炎症機能が弱まるため、皮膚アレルギーが悪化していることがわかりました。
-
このメカニズム解明によりストレス性の皮膚アレルギー炎症に対する新規治療法開発が期待されます。
背景
「病は気から」という古い諺(ことわざ)にもあるように、精神的ストレスは自己免疫疾患やアレルギー、がんを含む様々な疾患の増悪や発症に関与することが知られています。特に、アトピー性皮膚炎(*4)は古典的な心身症の分類であるHoly sevenの一つにも数えられていたこともあり、その発症や悪化には精神的ストレスが深く関わっていると考えられてきました。しかしながら、この分子メカニズムについてはまだ十分解明されておらず、長らく不明なままでした。本研究では、このメカニズムを解明するために考案した、独自のストレス負荷プロトコールをアレルギー性皮膚炎マウスモデルに応用することで解析を行いました。
内容
マウスにストレス負荷をかけた後にアレルギー性皮膚炎を発症させたところ、皮膚炎症の悪化(皮膚の腫れの増大や、炎症を起こす免疫細胞の集積が増加)が再現できました(図1)。このアレルギー皮膚炎症の悪化は、交感神経を除去したマウスやマクロファージだけにβ2アドレナリン受容体を欠損するマウスでは観察されないことから、交感神経から放出されるノルアドレナリン(*5)と呼ばれるストレスホルモンがストレスによって交感神経活動が亢進したために多量に放出され、これがマクロファージのβ2アドレナリン受容体に作用することで引き起こされていることが示唆されました(図2)。
興味深いことに、ストレスホルモンに晒されたマクロファージは炎症抑制機能に関連する遺伝子の発現が減少していることも判明し、さらに、ストレス負荷をかけたマウスの炎症組織にいる抗炎症マクロファージでは実際に炎症抑制機能も弱まっていることが確認されました。通常のアレルギー反応では、炎症を引き起こす反応(アクセル)と抑制する反応(ブレーキ)が同時に起こっており、炎症を引き起こす反応が炎症を抑制する反応を上回るとアレルギー炎症が強く引き起こされます。本研究結果から、炎症のブレーキ役を担っていたマクロファージの機能がストレスによって弱まったことにより、相対的に炎症を引き起こす反応が強くなってしまったため、皮膚アレルギー炎症が悪化していると考えられました(図3)。
また、ストレスによって抗炎症作用が弱まった皮膚炎症組織では細胞の死骸が蓄積してしまい、これによりダメージ関連分子パターン(DAMP)と呼ばれる因子が増加し、これが新たな炎症を起こす引き金となっていると考えられました。そこで、DAMPによって引き起こされる炎症を抑えるために、この反応に関連する分子であるCaspase-1(*6)やインフラマソーム(*7)関連分子(NLRP3)の阻害剤をマウスに投与するとストレスによって悪化した皮膚アレルギー炎症が消失することもわかりました。
今後の展開
今回、研究グループは、特化した治療薬がなく、発症メカニズムも不明であった精神的ストレスによる皮膚アレルギー増悪メカニズムを解明しました。本研究によってストレスが免疫細胞の性質まで変えてしまうことが明らかになったことから、本成果は皮膚アレルギーのみならず、他のストレス関連性の疾患がどのようにして発症しているかを解き明かすヒントにもなると期待されます。また、Caspase-1阻害剤がマウスモデルでは有効であったことから、こうしたストレス性の皮膚アレルギー治療には有用である可能性があり、今後更なる研究を進めていく必要があります。

マウスに精神的ストレスを負荷させる(ストレス)、または、ストレスをかけないマウス(コントロール)の耳に皮膚アレルギーを誘導したところ、アレルギー炎症による皮膚の腫れや炎症組織に浸潤する好酸球(アレルギーに関与する免疫細胞)の数が増えていた。
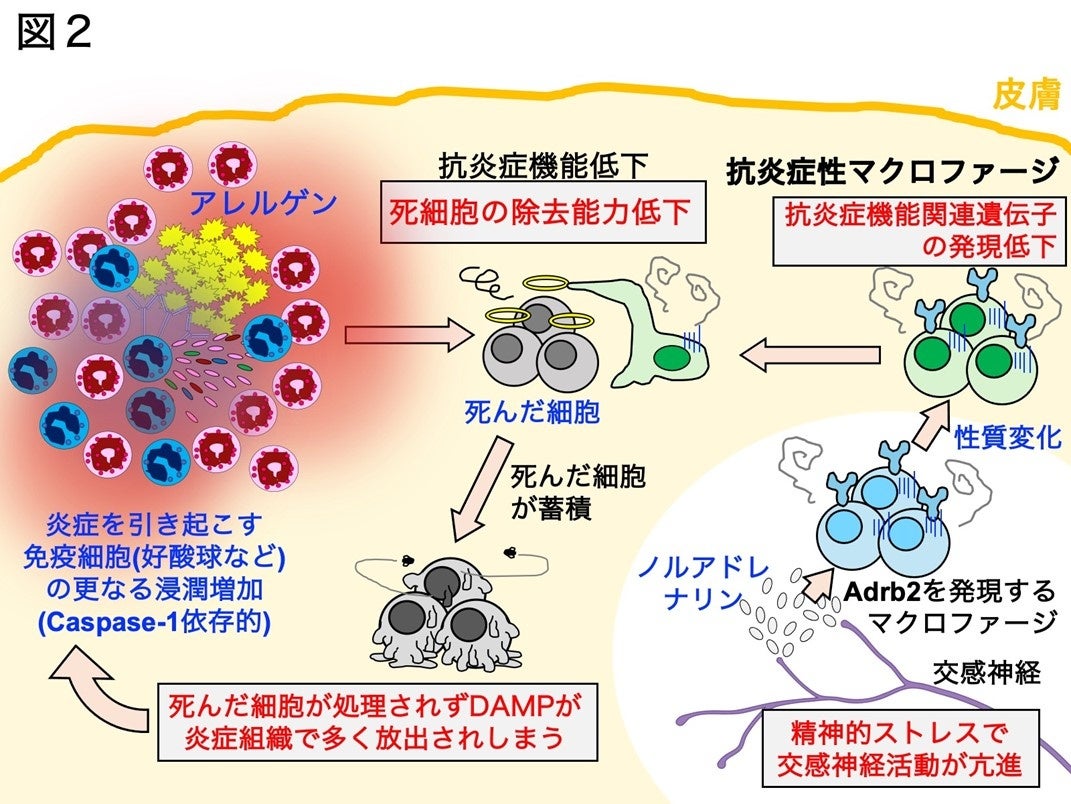
精神的ストレスにより活動亢進した交感神経末端からノルアドレナリンが放出され、これがAdrb2を発現している抗炎症性マクロファージに作用することで細胞の性質が変化し、抗炎症機能に関連する遺伝子(死細胞を除去する分子)の発現が低下する。これにより、死んだ細胞を除去する機能が抗炎症性マクロファージで低下してしまい、死んだ細胞が炎症組織で除去されずに蓄積し、死んだ細胞から放出されるDAMPが炎症をさらに惹起することで皮膚アレルギーの炎症が増悪してしまう。
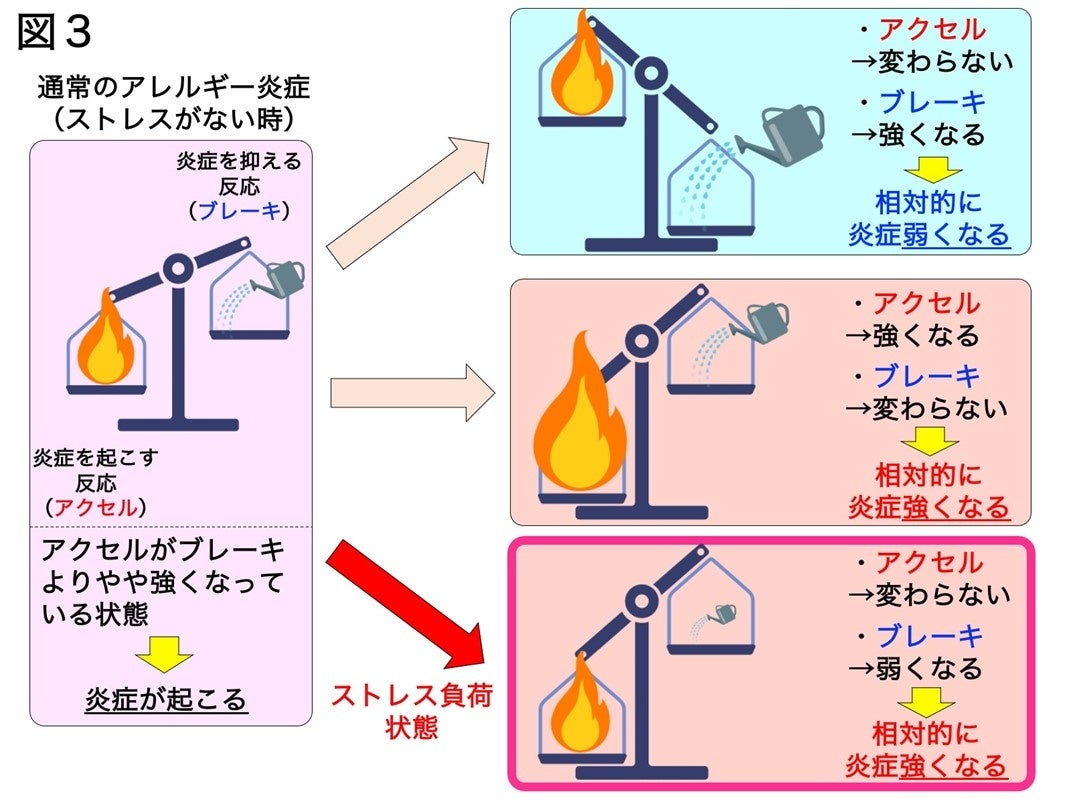
一般的に、アレルギーには炎症を起こす反応(アクセル)と炎症を抑制する反応(ブレーキ)が同時に起こっています。アクセルの強さがブレーキの強さを上回ると炎症が現れます。この時、さらにブレーキの力が強くなる時(右最上段)炎症は弱くなり、反対にアクセルの力がさらに強くなれば(右中段)炎症が悪化します。しかし、本研究のストレス負荷時のようにブレーキ役を担うマクロファージの抗炎症の力が弱くなると相対的にアクセルの力が強くなり、炎症が強くなって現れると考えられます。
用語解説
*1 交感神経: 自律神経系の一部で、体がストレスや緊急時に備える「戦うか逃げるか(Fight or Flight)」の反応を引き起こします。心拍数の増加や瞳孔の拡大、エネルギー供給の促進などを制御します。末端からノルアドレナリンを分泌します。
*2 マクロファージ: 免疫系の細胞の一種で、体内の異物や病原体を捕食(貪食)し、炎症や組織修復を促します。抗炎症のマクロファージは死んだ細胞を除去して炎症を抑制する機能も持ちます。
*3 β2アドレナリン受容体: アドレナリンやノルアドレナリンに応答する受容体の一種で、主に気管支の拡張や血管の拡張に関与します。免疫細胞にも存在し、免疫応答の調節にも関わることが知られています。
*4 アトピー性皮膚炎: 慢性的な炎症を特徴とする皮膚疾患。強いかゆみや湿疹が主な症状で、免疫細胞によるアレルギー反応や皮膚のバリア機能の異常が関与していると考えられています。
*5 ノルアドレナリン: 神経伝達物質およびホルモンとして機能し、交感神経系で主に用いられます。心拍数の上昇や血圧の調整など、ストレス反応に関わる重要な役割を果たします。
*6 Caspase-1: 酵素の一種で、インフラマソームの活性化により誘導されます。炎症性サイトカイン(特にIL-1βやIL-18)の産生を促し、炎症反応を引き起こします。
*7 インフラマソーム: 細胞内に存在するタンパク質複合体で、病原体や損傷による危険信号に反応して炎症を誘導します。Caspase-1の活性化を通じて、一部の炎症性サイトカインの活性を調整します。
研究者のコメント
「ストレス社会」と称される現代社会では、仕事や人間関係、生活環境から生じるストレスが私たちの心身に大きな影響を及ぼしています。こうしたストレスは我々に疲労感を与えるだけでなく、性格をもしばしば変えてしまいます。でも実は、ストレスで疲弊し、性格が変わってしまうのは免疫細胞も同じなのです。性質が変わってしまった免疫細胞は本来の働きができなくなってしまい、病気につながったり、症状の悪化を招いたりする恐れがあります。病気になりにくい体を作るためにも、ストレスを溜め込まない生活を心がけましょう。
原著論文
本研究はJournal of Allergy and Clinical Immunology誌のオンライン版で(2024年11月18日付)先行公開されました。
タイトル: Stress-experienced monocytes/macrophages lose anti-inflammatory function via β2-adrenergic receptor in skin allergic inflammation
タイトル(日本語訳): 精神的ストレスは単球・マクロファージのβ2アドレナリン受容体を刺激して抗炎症機能を低下させ皮膚アレルギー炎症を増悪させる
著者: Hitoshi Urakami, Soichiro Yoshikawa, Kei Nagao, Kensuke Miyake, Yuki Fujita, Ayaka Komura, Miho Nakashima, Ryusuke Umene, Shuhei Sano, Zheyu Hu, Emi Nishii, Atsushi Fujimura, Takeshi Y. Hiyama, Keiji Naruse, Hajime Karasuyama, Tsuyoshi Inoue, Mitsutoshi Tominaga, Kenji Takamori, Shin Morizane, Sachiko Miyake
著者(日本語表記): 浦上仁志1)2)、吉川宗一郎1)4)、長尾圭1)4)、三宅健介5)、藤田悠紀 1)、小村彩可1)、中島美穂1)、梅根隆介6)、佐野修平3)、胡哲宇3)、西井慧美3)、藤村篤志1)、檜山武史7)8)、成瀬恵治9)、烏山一5)、井上剛6)、冨永光俊4)、髙森建二4)、森実真2)、三宅幸子3)
著者所属:1)岡山大学細胞生理学講座、2)岡山大学皮膚科学講座、3)順天堂大学免疫学講座、4)順天堂大学環境医学研究所、5)東京科学大学総合研究院、6)長崎大学内臓機能生理学、7)鳥取大学統合生理学講座、8)鳥取大学国際乾燥地研究教育機構、9)岡山大学システム生理学講座
DOI: 10.1016/j.jaci.2024.10.038
本研究はJSPS科研費JP22K07119, JP19K07620、順天堂大学環境医学研究所プロジェクト研究助成、公益財団法人ホーユー科学財団研究助成、公益財団法人大下財団研究助成、および文部科学省私立大学戦略的研究基盤形成事業の支援を受け多施設との共同研究の基に実施されました。
なお、本研究にご協力いただいた皆様には深謝いたします。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
