ミトコンドリアDNAの制御メカニズムの理解の前進
― ミトコンドリアDNAの複製と転写のバランスの調節の仕組み ―
順天堂大学大学院医学研究科分子病理病態学の安川 武宏 准教授、康 東天 九州大学名誉教授、および、東北大学加齢医学研究所の松田 盛 助教らの研究グループは、ミトコンドリアDNA*1の複製と転写の制御メカニズムの理解の前進に大きく貢献する研究成果を発表しました。研究グループは、ヒト培養細胞においてミトコンドリアDNAの転写に関わるタンパク質であるミトコンドリア転写伸長因子TEFMをゲノム編集技術を用いて消失させることに成功し、この細胞のミトコンドリアDNAの複製*2や転写*3の状態を詳しく解析することから、同因子がこれらの2つの重要な機能の相互バランスの調節に関与している可能性を示しました。本研究成果はNature Portfolioが発刊しているCommunications Biology誌に2025年2月8日付で公開されました。
本研究成果のポイント
-
ミトコンドリア転写伸長因子TEFMを消失させたヒト培養細胞株を多数樹立しました。
-
TEFMがミトコンドリアDNAの転写と複製のバランスの維持に関与していることを示しました。
-
ミトコンドリアDNAの異常によって生じる疾患の理解の深化への貢献が期待されます。
背景
細胞内に存在するミトコンドリアは、細胞、ひいては人間の活動に必要なエネルギーを産生する重要な細胞小器官です。そして、核に存在するDNAとは別の独自のDNA、ミトコンドリアDNA(mtDNA)をもつことが特徴です。mtDNAにはエネルギー産生に関わるタンパク質装置の遺伝子が書き込まれており、mtDNAに生じた異常がミトコンドリア病とよばれる疾患の原因になるなど、がんを含む様々な疾患に関与します。mtDNAの複製や、遺伝子情報を書き出す転写の制御は、核DNAのそれらの制御とは異なることが知られていますが、その詳細についてはまだまだ未解明の部分が残されています。本研究ではmtDNAの複製と転写というmtDNAの機能発現のカナメとなる重要な機構がどのようにして相互のバランスを維持しているのかという根源的な命題に挑戦し、mtDNAに対する理解の深化を目指しました。
内容
ヒトmtDNAは 16,569塩基対の環状2本鎖DNAで1細胞あたり数百から数千コピー存在します。2本の鎖はそれぞれH鎖、L鎖とよばれて区別され、各鎖の転写はL鎖転写プロモーター(LSP)、H鎖転写プロモーター(HSP)と呼ばれる位置から開始されてmtDNAを1周するように進むことで各鎖にコードされている遺伝子をRNAに転写します。一方で、多くのmtDNA複製はLSPの下流約200塩基の位置に存在する複製開始点OHから開始されます。このときLSPから転写された約200塩基のRNAがプライマーとして働いてOHからDNA合成がおきます。そのため、OHでRNA合成(転写)がDNA合成(複製)に切り替わるか否かの適切な制御が、転写と複製のバランス維持、ひいてはmtDNAの機能発揮に重要と考えられます(図1)。
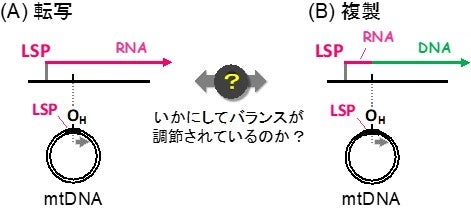
図1 mtDNAのL鎖の転写(A)と複製(B)の開始の模式図。いずれもLSPからのRNA合成によって開始され、OHでRNA合成がDNA合成に切り替わることで複製が開始されます。一方、切り替わらずRNA合成が進行すれば遺伝子の転写となります。
今回、研究グループはmtDNAの転写(RNA合成)を行うミトコンドリアRNAポリメラーゼ(POLRMT)と複合体を形成し、確実な転写伸長反応を担保する役割をもつミトコンドリア転写伸長因子(mitochondrial transcription elongation factor: TEFM)に注目し、ゲノム編集技術を用いて核DNAにコードされている同遺伝子をヒト培養細胞で破壊し、TEFMタンパク質が発現しなくなったTEFMノックアウト細胞株を多数樹立しました。そして、これらの細胞株のmtDNAの複製と転写を詳しく解析したところ、複製活性が顕著に低下する一方、転写開始活性が上昇していることを明らかにしました(図2)。加えて、野生型細胞に対してTEFMをターゲットにした共免疫沈降実験を行ってTEFMと相互作用するタンパク質を調査したところ、TEFMと複合体を形成することが知られているPOLRMTだけでなく、mtDNA複製を司るDNAポリメラーゼγ(POLG)もTEFMと相互作用することを明らかにしました(図2)。
研究グループはこれらの実験結果等を総合的に考察し、TEFMはPOLRMTの補助因子として転写を確実に進行させる役割だけでなく、mtDNAの複製起点OHでRNA合成がDNA合成に切り替わるのを促進する因子でもあるという、TEFMの第2の役割を提唱するに至りました。
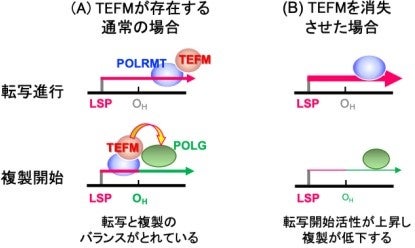
図2 mtDNAの転写-複製調節におけるTEFMの役割の提案図。(A)TEFMが存在するとき転写と複製のバランスが保たれた状態です。(B)実験的にTEFMを消失させたところ、OHでのRNA合成からDNA合成への移行が通常のようにおきなくなったことから、TEFMが移行を促進する因子であることが示唆されました。
今後の展開
研究グループは、生命活動の根幹であるミトコンドリアのエネルギー産生に直結するタンパク質装置の遺伝子が書き込まれたmtDNAの複製と転写の制御という根源的な課題に、細胞生物学・分子生物学的実験手法を駆使して取り組み、その制御の理解の深化に貢献しました。今後、この研究成果に基づいてmtDNAの機能発揮メカニズムや、その破綻と疾患・加齢との関係への理解が進むことが期待されます。
用語解説
*1 ミトコンドリアDNA : ミトコンドリア内に存在する核DNAとは別の独自のDNA。全ての人がもっている。
*2 DNA複製 : 遺伝情報を保持するDNAを次の世代に受け継ぐためにコピーを作成する機構のこと。
*3 転写 : DNAに書き込まれた遺伝情報をタンパク質として合成するために必要な鋳型であるRNAを、DNAを鋳型として合成する機構のこと。
研究者のコメント
疾患の原因解明や治療の開発を目指す応用研究だけでなく、今回発表することができたような生命現象の原理に迫る基礎研究を行うことは研究者としての醍醐味のひとつです。地道な基礎研究の成果の上に応用研究が成り立ちますので、人や社会に役立つ応用研究の礎となる意味のある基礎研究を進めて成果を挙げていきたいと考えています。
原著論文
本研究はCommunications Biology誌に2025年2月8日付で公開されました。
タイトル: TEFM facilitates transition from RNA synthesis to DNA synthesis at H-strand replication origin of mtDNA
タイトル(日本語訳): TEFMはミトコンドリアDNAのH鎖複製起点におけるRNA合成からDNA合成への移行を促進する
著者:Shigeru Matsuda1,2, Masunari Nakayama1, Yura Do1, Takashi Ishiuchi3,4, Mikako Yagi1,5, Sjoerd Wanrooij6, Kazuto Nakada7, Fan-Yan Wei2, Kenji Ichiyanagi8, Hiroyuki Sasaki3, Dongchon Kang1, Takehiro Yasukawa1,9
著者(日本語表記):松田 盛1,2、中山 益成1、都 由羅1、石内 崇士3,4、八木 美佳子1,5、Sjoerd Wanrooij6、中田 和人7、魏 范研2、一柳 健司8、佐々木 裕之3、康 東天1, 安川 武宏1,9
著者所属: 1) 九大・院医・臨床検査医学, 2) 東北大・加齢医学・モドミクス医学, 3) 九大・生医研・エピゲノム, 4) 山梨大・生命環境, 5) 九大・院医・保健学, 6) Umeå Univ, 7) 筑波大・生命環境, 8) 名古屋大・院生命農学・動物科学, 9) 順天堂大・院医・分子病理病態学
DOI:10.1038/s42003-025-07645-4
本研究は科研費JP17K07504, JP20H00530、および、日本私立学校振興・共済事業団の「私立大学等経常費補助金」等の交付を受けて実施・発表したものです。また、本研究は多施設(海外を含む)との共同研究の基に実施されました。本研究にご協力いただいた皆様に深謝いたします。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
