遺伝性難聴へのゲノム編集技術を開発
―内耳の異常タンパク質を修復する新たな難聴治療技術―
順天堂大学医学部耳鼻咽喉科学講座の神谷和作 准教授、宇梶太雄 非常勤助教ら、および東京大学大学院理学系研究科生物科学専攻 濡木理 教授らの共同研究グループは、これまで根本的治療の存在しなかった遺伝性難聴*¹に対して独自の遺伝子送達技術と遺伝子編集技術を組み合わせることにより患者内耳の遺伝子変異を効率よく修復して内耳の異常タンパク質を修復する新技術を開発しました。
生まれつきの難聴のほとんどは遺伝子変異による難聴(遺伝性難聴)であり、その最も大きな原因がGJB2*²と呼ばれる遺伝子の変異です。世界ではGJB2などの正常遺伝子を補充する治療の研究は進んでいましたが、顕性(優性)遺伝型と呼ばれる遺伝子変異のタイプでは遺伝子の補充は効果がなく、遺伝子情報を書き換えるゲノム編集の技術が必要とされていました。しかし遺伝子の大きさや書き換えの効率など、技術的な困難によって有効な方法が開発されていませんでした。
本研究では順天堂大学医学部耳鼻咽喉科学講座で独自に開発した内耳への遺伝子送達技術(アデノ随伴ウィルスベクター:AAV)*³と東京大学で開発した最新のゲノム編集技術*⁴(SaCas9-NNG-ABE)を組合わせた難聴への遺伝子治療技術によりGJB2と呼ばれる代表的な難聴遺伝子の変異箇所を効率よく書き換えて、内耳タンパク質の機能を正常に回復させる技術開発に初めて成功しました。
本論文はJCI Insight誌のオンライン版に2025年3月11日(日本時間)に公開されました。
本研究成果のポイント
● 内耳への遺伝子送達技術を新規開発
● 新規ゲノム編集ツールを内耳細胞へ送達
● 遺伝性難聴の内耳で変異遺伝子を修復し正常に機能させることに成功
背景
遺伝性難聴は130種以上の遺伝子の変異が原因で発症しますが、世界で最も大きな原因となるのがGJB2(Gap Junction Protein Beta 2)と呼ばれる遺伝子の変異です。GJB2は内耳の「ギャップ結合*⁵」と呼ばれるタンパク質の構成成分であり、内耳のイオン濃度を一定に保つ役割をしています(図1,左)。
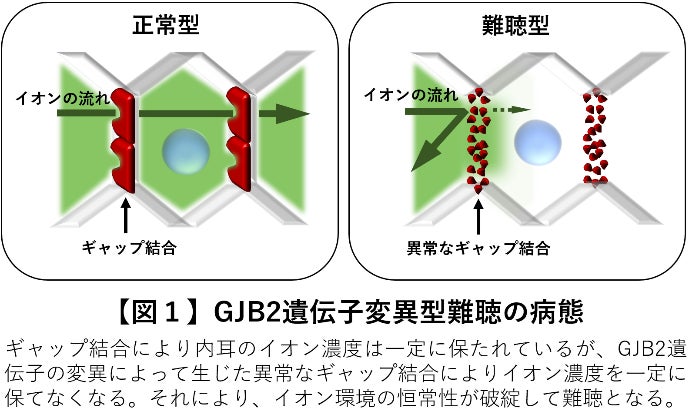
これまで順天堂大学の研究グループはGJB2遺伝子の変異によって異常なギャップ結合ができる難聴のメカニズムを難聴モデル動物やiPS細胞などを用いて解明してきました。(順天堂大学プレスリリース2014*a、2016*b、2021*c)(図1,右)。さらに難聴のマウスにGJB2遺伝子を補充して聴力を回復させる治療技術の開発に世界で初めて成功しました(順天堂大学プレスリリース2015*d)。しかし顕性遺伝(優性遺伝)と呼ばれるタイプの変異では変異遺伝子によって作られる変異タンパク質自体が内耳の機能を阻害するため、正常なGJB2遺伝子の補充では機能は回復しません。そのため変異遺伝子の遺伝情報を効率的に正常型に書き換える「ゲノム編集ツール」とそれを内耳の細胞に送り届ける遺伝子の運び屋「遺伝子治療ベクター」という二つの新技術を組み合わせる必要がありました。
内容
順天堂大学の研究チームは、遺伝子を内耳へ送り届けることができるアデノ随伴ウイルスベクター(AAV)と呼ばれる遺伝子の運び屋「遺伝子治療ベクター」を遺伝子組み換えによって開発しました(図2,左上)(論文投稿中)。しかしAAVに搭載できる遺伝子のサイズに制限(一般的には4.7Kbpまで)があるため、遺伝子サイズが大きい従来のゲノム編集ツール(ゲノムを編集するための遺伝子セット)を1個の遺伝子治療ベクターだけで内耳に運ぶことは困難で、2個の遺伝子治療ベクターに分けて行う必要がありました。また、従来の方法では編集できる遺伝子の場所に制約があり、標的にできない遺伝子変異も多くありました。
これを解決するため、東京大学の研究チームは従来型のゲノム編集ツールよりも遺伝子サイズが小さく、標的範囲が広い新しいゲノム編集ツール「SaCas9-NNG-ABE」を開発しました(論文審査中、プレプリント*e公開中)(図2,右上)。
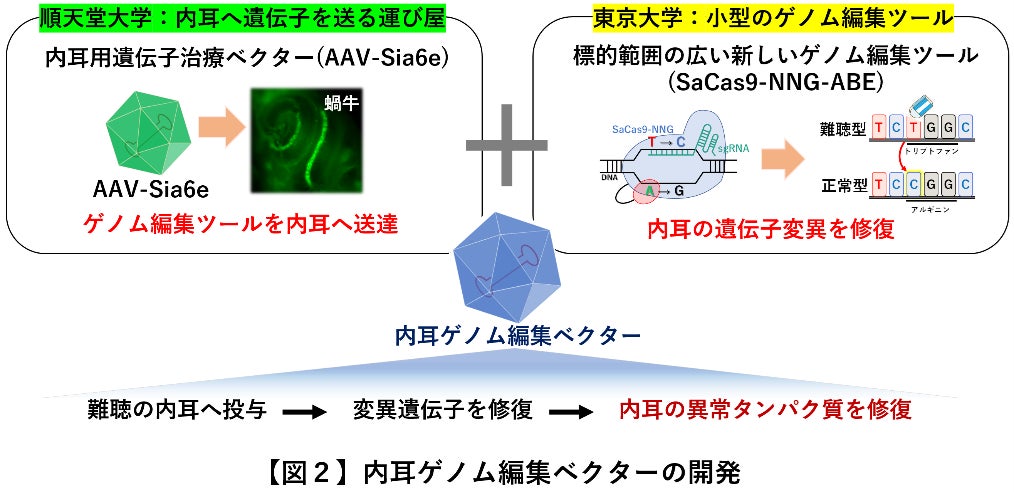
そこで、東京大学の新型ゲノム編集ツール「SaCas9-NNG-ABE」を順天堂大学の内耳用遺伝子治療ベクター「AAV-Sia6e」に搭載して更に改良を進め、新たな遺伝子治療薬、「内耳ゲノム編集ベクター」を開発しました。
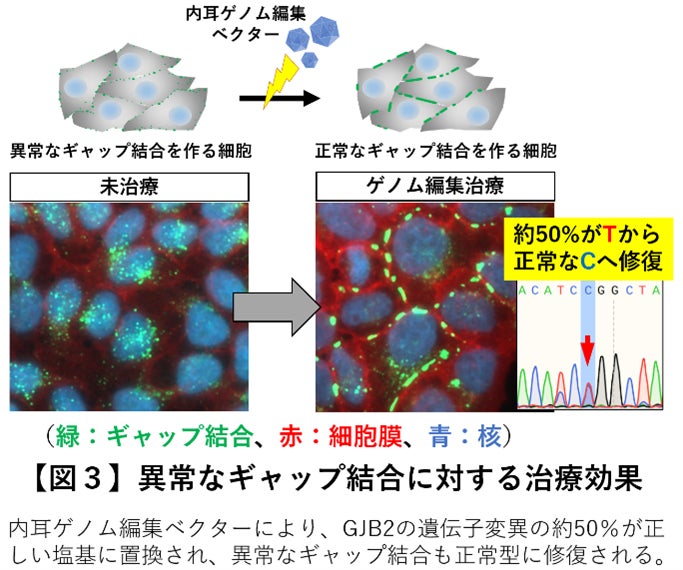
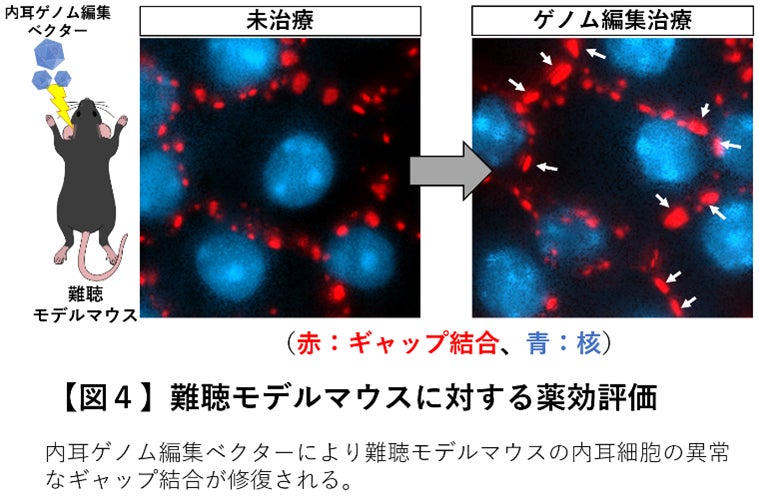
このベクターにて顕性(優性)遺伝型のGJB2遺伝子変異型難聴 (GJB2 R75W)を持つモデル動物やモデル細胞に対するゲノム編集治療をおこなったところ、一回の投与で標的とする遺伝子変異を効率よく修復(変異型Tを正常型Cへ修復)し、疾患モデル細胞(図3)と難聴モデルマウス(図4)の両方で内耳のイオン環境の恒常性維持に重要なギャップ結合タンパク質の構造体に明らかな改善を認めました。さらに修復されたギャップ結合では本来の物質輸送能が回復していることを確認しました(図5)。
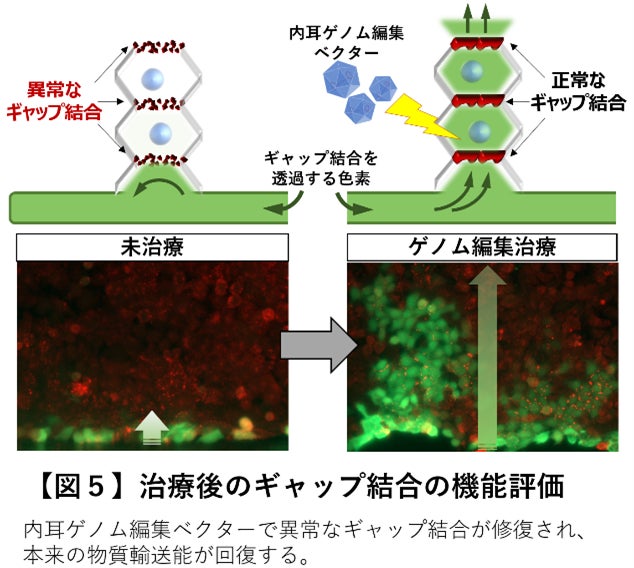
今後の展開
今回、研究グループは従来治療法がなかったGJB2変異型遺伝性難聴の代表的変異を独自の内耳用AAVベクターとゲノム編集技術で修復する方法を開発しました。
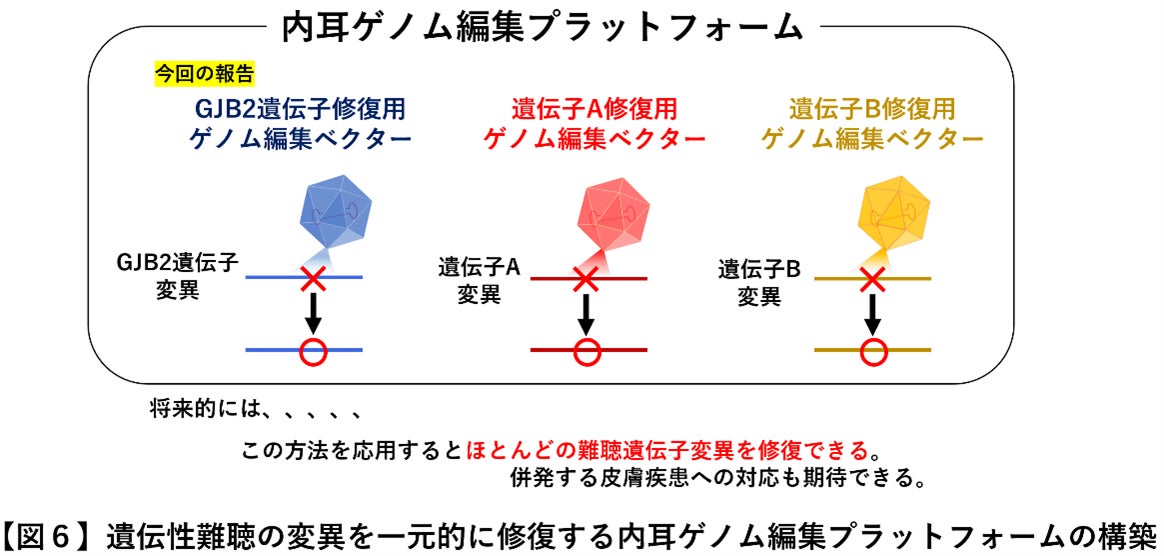
AAVベクター、ゲノム編集ともにどちらも期待されている遺伝子治療法であり、今回二つの最新技術を組み合わることにより遺伝性難聴の病態を1つの遺伝子治療ベクターのみで修復できる内耳ゲノム編集ベクターの開発に成功しました。今回開発した内耳ゲノム編集ベクターは従来型では編集の困難であった遺伝子変異に対するゲノム編集が可能であるため、同技術を応用するとさまざまなタイプの難聴遺伝子変異型を修復することが可能となります。最近では生まれつきの難聴(先天性難聴)だけではなく、正常な聴力で生まれても若年期に難聴を発症する、若年発症型両側性感音難聴(指定難病)の遺伝子変異も多く発見されています。今後は多種多様な原因遺伝子と変異型を有する遺伝性難聴に対し、それらを一元的に修復する内耳ゲノム編集プラットフォームを構築することを目指します(図6)。また、今回対象としたGJB2 R75W変異は難聴だけでなく皮膚疾患を併発するため、将来的には皮膚疾患への適用にも期待できます。
用語解説
*1 遺伝性難聴:遺伝性難聴は出生児1,600人に1人程度の割合で発症する。生まれつきの難聴(先天難聴)の約半数は遺伝性難聴。生まれつきではなく正常な聴力で生まれて若年期に発症する遺伝性難聴、若年発症型両側性感音難聴(指定難病)においても多くの原因遺伝子変異が見つかっている。現時点での根本的治療法や治療薬は存在しない。
*2 GJB2:GJB2(GAP JUNCTION PROTEIN, BETA-2)遺伝子は世界で最も高頻度に検出される遺伝性難聴の原因因子であり、内耳のギャップ結合の構成成分である。GJB2遺伝子変異は我が国で検出される遺伝子変異の約半数を占めるとされており、常染色体顕性(優性)と常染色体潜性(劣性)の遺伝形式を持つ。
*3 アデノ随伴ウィルスベクター(AAV):ウイルスベクターの一種であり、遺伝子を送る運び屋。ヒトに対する病原性が非常に低く、宿主内での遺伝子発現が長期間持続することから臨床応用に向けた開発が進んでいる。本研究では、独自に開発したカプシド改変によりギャップ結合を形成する内耳支持細胞に広範囲に感染するAAVを用いてゲノム編集治療に応用した。
*4 ゲノム編集技術:ゲノム内のDNA配列を意図的に切断、挿入、および書き換える技術。これにより遺伝子の機能を「停止」、「追加」および「修復」することができる。本研究では、A-T塩基対からG-C塩基対への転位を可能にするアデニン一塩基エディター(ABE)を用いてゲノム編集をおこなった。
*5 ギャップ結合:コネキシンは6個の集合体により細胞膜に分子の通り道を作り、隣の細胞の集合体と連結して細胞と細胞をつなぐトンネルを作る。このギャップ結合は分子量約1000以下の低分子やイオンを濃度勾配によって透過させ、細胞間の物質輸送を可能とする。
*aプレスリリース:遺伝性難聴の原因メカニズムを解明 (2014.03.03)
*bプレスリリース:iPS細胞から遺伝性難聴の原因となる内耳ギャップ結合形成細胞を作製(2016.11.11)
https://www.juntendo.ac.jp/news/02928.html
*cプレスリリース:患者iPS細胞で遺伝性難聴を再現(2021.05.18)
https://www.juntendo.ac.jp/news/00173.html
*dプレスリリース:遺伝性難聴の根本的治療に成功(2015.04.06)
*e Molecular engineering and dynamic activation mechanism of a PAM-flexible compact CRISPR-Cas9. https://www.researchsquare.com/article/rs-4619764/v1
原著論文
本研究はJCI insight誌のオンライン版に2025年3月11日(日本時間)に公開されました。
タイトル: AAV-mediated base editing restores cochlear gap junction in GJB2 dominant-negative mutation-associated syndromic hearing loss model
タイトル(日本語訳): AAVを介したゲノム編集(塩基編集)技術は症候性難聴を引き起こすGJB2優性阻害変異難聴モデルの蝸牛キャップ結合を修復する
著者: Takao Ukaji1, Daisuke Arai1, Harumi Tsutsumi1, Ryoya Nakagawa2, Fumihiko Matsumoto1, Katsuhisa Ikeda1, Osamu Nureki2 and Kazusaku Kamiya1
著者(日本語表記): 宇梶太雄1、新井大祐1、堤晴美1、中川綾哉2、松本文彦1、池田勝久1、濡木理2、神谷和作1
著者所属: 1)順天堂大学医学部耳鼻咽喉科学講座、2)東京大学大学院理学系研究科生物科学専攻
DOI: https://doi.org/10.1172/jci.insight.185193.
本研究は、国立研究開発法人日本医療研究開発機構(AMED)難治性疾患実用化研究事業、20ek0109401h0003(研究開発代表者 神谷和作)、AMED再生医療実現拠点ネットワークプログラム、23bm0704061h0003(研究開発代表者 神谷和作)、AMED難治性疾患実用化研究事業、24ek0109729h0001(研究開発代表者 神谷和作)の支援を受け多施設との共同研究の基に実施されました。
本研究にご協力いただいた皆様には深謝いたします。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
