乳がんの抗がん剤治療に朗報!
―副作用が少なく、しっかり吐き気を抑えてくれる第4の制吐剤少量投与の有効性と安全性に関する研究報告―
順天堂大学大学院医学研究科乳腺腫瘍学の齊藤光江特任教授、岐阜大学附属病院薬剤部の飯原大稔博士、および順天堂大学薬学部の尾関理恵准教授ら合計15医療機関の共同研究グループは、乳がんに対する高度に吐き気を誘発する抗癌剤治療において、3種類の制吐剤点滴に加えて、オランザピンという内服薬が、これまで推奨されてきた10mgの半量で、安全かつ顕著に吐き気や嘔吐を抑えるということを明らかにしました。
高度に嘔気嘔吐を誘発する抗癌剤には、セロトニン受容体やNK-1受容体の拮抗剤、デキサメタゾンの3剤併用制吐療法が推奨されてきました。近年オランザピン10mgの4日間内服を加えると、更に制吐効果を高めることが示されましたが、ふらつき等の副作用が問題でした。主に入院治療のシスプラチンには5mgの有効性が示されましたが、乳がんのAC療法*¹は、通院治療が主であり、更に高い安全性が求められました。
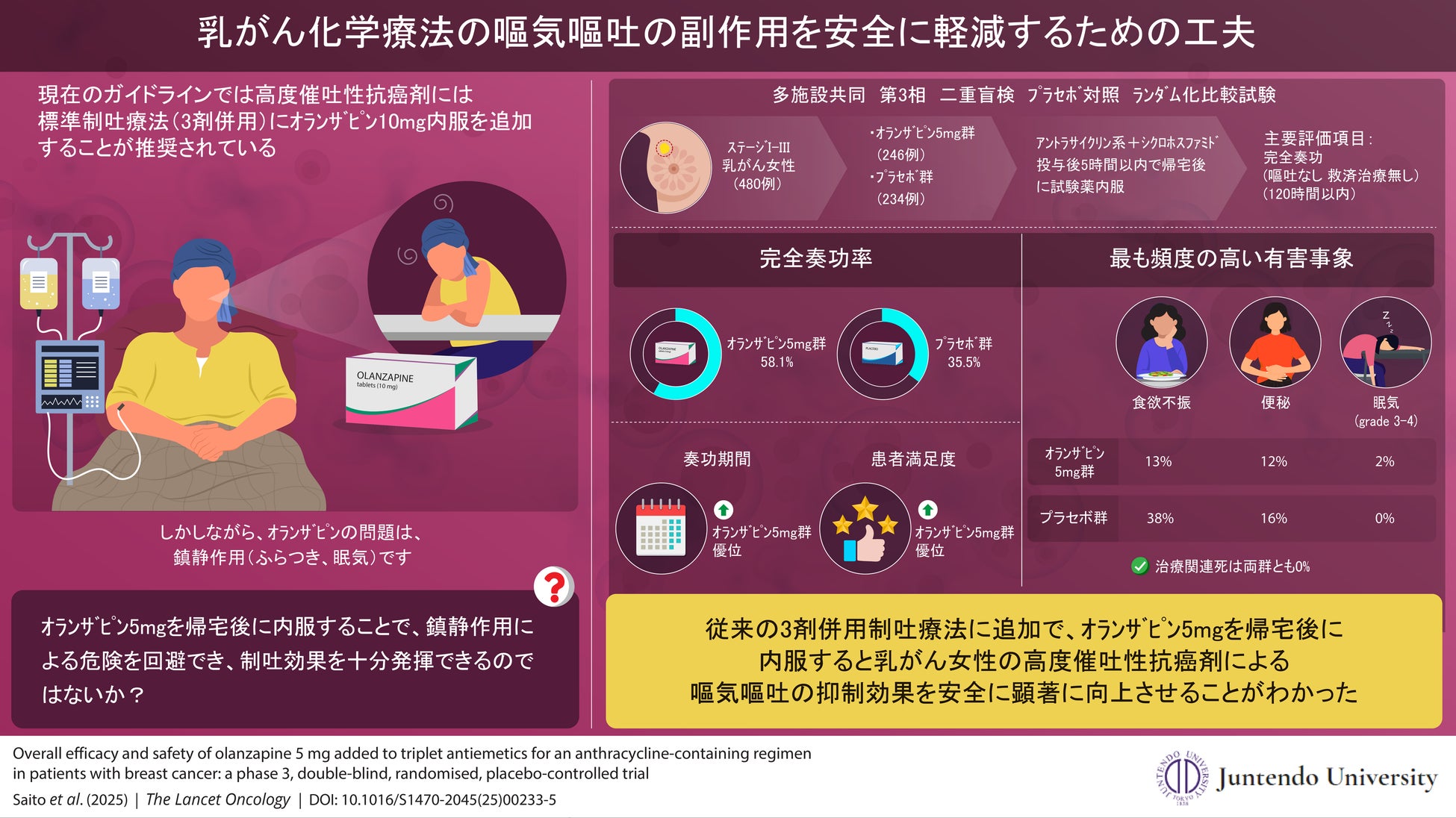
そこで、研究グループは国内15施設500人の乳がん患者を対象にAC療法開始から120時間以内に「嘔吐なし、救済治療(吐き気止めの頓服)なし」を表す完全奏功(CR)を3剤併用にオランザピン5mgを加える群と、プラセボを加える群に無作為割付し、患者日誌を用いて評価しました。
その結果、CR率は、オランザピン群(58·1%)で、プラセボ群(35·5%)に比して顕著に高く、安全性の高さも証明されました。少量で有効かつ安全な治療は患者の経済的負担軽減にもつながり、昨今問題になっている経済毒性への一つの対処法にもなります。
本論文はThe Lancet Oncologyのオンライン版に2024年6月17日付で公開されました。
本研究成果のポイント
● 患者の声をもとに実施された、医療者主導の多施設共同プラセボ対照二重盲検ランダム化比較試験。
● AC療法によって誘発される乳がん患者の嘔吐事象が、既存の3剤併用制吐療法と比較し、オランザピン5mgを追加することで有意に抑制され、ふらつき等の重篤な有害事象も認めなかった。
● オランザピンはガイドラインで10mgが第一選択であるが、5mgの有用性が見直される可能性がある。
背景
シスプラチンやアントラサイクリ系薬剤とシクロホスファミドの併用療法(AC療法)等の高度催吐性抗癌剤*²には、セロトニン受容体拮抗剤、NK-1受容体拮抗剤、デキサメタゾンの3剤併用制吐療法が推奨されてきました。近年、複数の神経伝達物質の受容体拮抗剤(MARTA*³)として精神科領域で使用されていたオランザピンの制吐作用が注目され、10mgを4日間内服すると吐き気を抑える効果が更に高まることが示されました(Navari*⁴ら)が、ふらつき等の副作用に注意喚起がなされていました。5mgの内服に関しては、橋本*⁵らが、シスプラチン(入院点滴が主)が誘発する嘔吐事象をプラセボと比較して有意に抑制することを示しましたが、乳がんに対するAC療法(外来点滴が主)は、嘔吐のリスク因子である女性、若い世代が多数であり、高齢者はふらつきに特に注意すべきことから、シスプラチンの臨床試験の結果の外挿はできず、今回の臨床試験の企画・立案に至りました。
内容
研究グループは、2020年10月から2022年11月にわたり500名の乳がん患者の協力を得、AC療法による嘔吐や吐き気(嘔吐事象)を120時間にわたって嘔吐なし、救済治療なしで過ごせる完全奏功(CR: Complete Response)を3剤併用(5-HT3受容体拮抗剤、NK-1受容体拮抗剤、デキサメタゾン)にオランザピン5mgを加える群と、プラセボを加える群に無作為に振り分けて、年齢(55歳以下とそうでない)と実施施設ごとに偏りなく割り付けし、両群間でCRの結果を比較しました。対象は、これまで中等度以上の抗癌剤治療歴が無く、AC療法が再発予防で計画されている乳がん患者。患者日誌を用いて、嘔吐事象と服薬内容の記録を取り、また症状の重さは、患者自身によるPRO-CTCAE v1.0と医療者によるCTCAE v5.0を用いて評価しました。
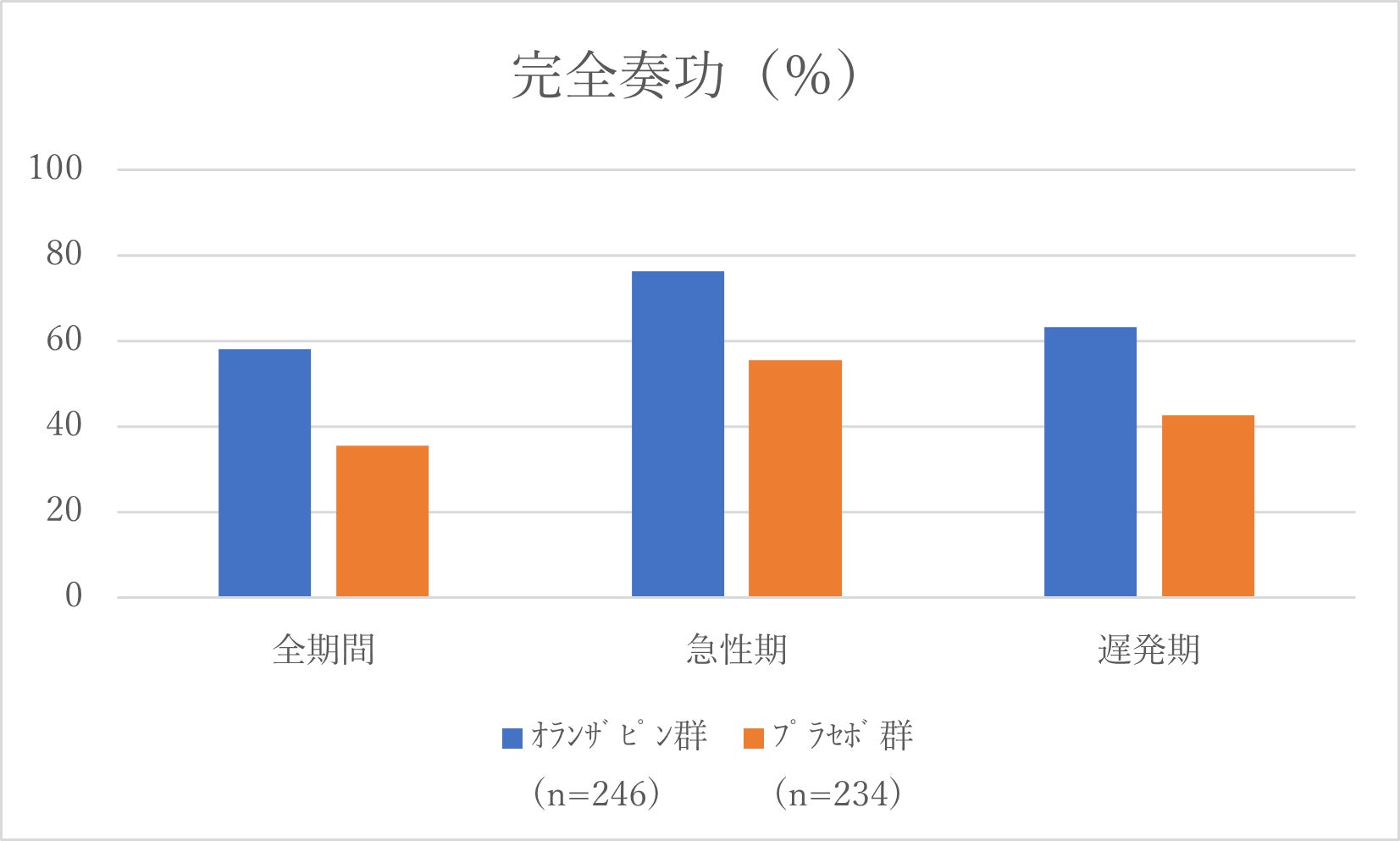
結果、CR率は、オランザピン群で58.1%(n=143)、プラセボ群で35.5%(n=83)と、 有意差をもって(95% CI 14.0–31.4%; p<0·0001)オランザピン群の制吐効果が高いことが証明されました。PRO-CTCAEによる重度もしくは非常に重度な症状は、食思不振(オランザピン群で33/246 [13%]、プラセボ群で 89/235 [38%])、便秘(オランザピン群で30/246 [12%]、プラセボ群で37 [16%])でした。重度もしくは非常に重度の集中力低下はオランザピン群で25/246 (10%) 、プラセボ群で34/235 (14%) でした。試験薬に関連する可能性がある、Grade3-4の有害事象は眠気がオランザピン群で4/246 [2%] 、プラセボ群で0/235[0%]と集中力障害がオランザピン群で2/246 [1%] に対してプラセボ群で0/235[0%]でした。またいずれの群も試験期間中の死亡例はありませんでした。
今後の展開
国際ガイドライン(ASCO 2020, MASCC/ESMO 2023など)においては、オランザピンの推奨用量の第一優先は10mgとなっており、高齢者など鎮静作用による有害事象が懸念される場合には、5mgが勧められている現状があります。本来10mg vs 5mg のランダム化比較試験で、優劣もしくは同等性が証明されることが理想ですが、比較試験が実施されていない現状があり、少なくとも並列で推奨されるべきと考えられます。しかしながら、最初に報告された10mgの嘔気抑制効果を科学的根拠として優先的に推奨されている経緯があります。また、主に通院で実施されるAC療法においては、安全な通院が保証されねばならないため、入院治療で施行される高度催吐性抗がん剤以上に、乳がんのAC療法は、ふらつき等の鎮静作用に留意が必要であり、5mgの推奨を広める必要があると考えられます。経済毒性も問題になっている中、本研究の結果が、低用量の支持医療(副作用に対処する医療)が推奨される潮流のきっかけになることを期待します。
用語解説
*1 AC療法:アントラサイクリン系抗癌剤(ドキソルビシン、エピルビシン等)とシクロホスファミドを含む化学療法レジメ(メニュー)
*2 高度催吐性抗癌剤:制吐剤を使用しなければ90%以上の人が24時間以内に嘔吐事象(嘔吐もしくは嘔気)を来す抗癌剤
*3 MARTA:Multi-Acting Receptor-Targeted Antipsychotics 多元受容体作用抗精神病薬
*4 NAVARI: 米国で長年CINVの研究を続けているRudolph M Navari医師
*5 橋本ら:国立がん研究センター中央病院薬剤部の橋本浩伸氏、浜松医大婦人科の安部正和医師ら
研究者のコメント
●抗癌剤が誘発する嘔吐事象は、多くの患者の苦痛や不安のもとになり、その軽減が望まれる。一剤一剤に開発の歴史があり、ガイドライン推奨の制吐療法が更新されてきました。オランザピンが加わり、過半数の患者の高度催吐性抗癌剤誘発嘔吐事象が抑えられるようになり、更に推奨用量の半分でも有効という本試験の結果は、心身の苦痛のみならず経済的な苦痛も軽減することが期待されます。
●本研究の発端は3人の患者からの不安の訴えでしたが、医療のエンドユーザーである患者が、研究の企画から参加できることが、本当の意味で患者中心の医療実現につながり、今後益々望まれます。
●多施設共同ランダム化比較試験を大学発で実施することは、次世代医療者に医療現場でのクリニカル・クエスチョンを解決する研究意欲を醸成することにつながり、本研究はその一端を担ったと考えられます。
原著論文
本研究はThe Lancet Oncology誌のオンライン版に2025年6月17日付で公開されました。
タイトル: Overall efficacy and safety of olanzapine 5 mg added to triplet antiemetics for an anthracycline-containing regimen in patients with breast cancer: a phase 3, double-blind, randomised, placebo-controlled trial
タイトル(日本語訳): 乳癌のAC療法誘発嘔吐事象に対してオランザピン5mgの3剤併用制吐療法への上乗せ効果および安全性検討第3相盲検化無作為化比較試験
著者:Prof Mitsue Saito, MDa,† ∙ Hirotoshi Iihara, PhDb,† ∙ Prof Mototsugu Shimokawa, PhDc ∙ Ryoko Udagawa, MSd ∙ Michiko Tsuneizumi, MDe ∙ Prof Manabu Futamura, MDf ∙ Yuko Ishikawa, MDg ∙ Prof Hideaki Ogata, MDh ∙ Hiroko Bando, MDi ∙ Hiroaki Shima, MDj ∙ Keiko Hosoya, MDk ∙ Toru Mukohara, MDl ∙ Kenichiro Tanaka, MDm ∙ Tomoki Ikuta, MSn ∙ Takahiko Kawate, MDo ∙ Kazushige Ishida, MDp ∙ Katsuya Nakai, MDa,q ∙ Toshitaka Uomori, MDa ∙ Prof Goro Kutomi, MDa,j ∙ Rie Ozeki, PhDa,r ∙ Naotake Yanagisawa, PhDs
a Department of Breast Oncology, Faculty of Medicine, Juntendo University, Bunkyo-ku, Tokyo, Japan
b Department of Pharmacy, Gifu University Hospital, Gifu-city, Gifu, Japan
c Department of Biostatistics, Yamaguchi University Graduate School of Medicine, Ube-city, Yamaguchi, Japan
d Department of Pharmacy, National Cancer Centre Hospital, Chuo-ku, Tokyo, Japan
e Department of Breast Surgery, Shizuoka General Hospital, Shizuoka-city, Shizuoka, Japan
f Department of Breast Surgery, Gifu University Hospital, Gifu-city, Gifu, Japan
g Department of Breast Oncology, Juntendo Urayasu Hospital, Urayasu-city, Chiba, Japan
h Department of Breast and Endocrine Surgery, Toho University Medical Centre Omori Hospital, Ota-ku, Tokyo, Japan
i Department of Breast and Endocrine Surgery, Institute of Medicine, University of Tsukuba, Tsukuba-city, Ibaraki, Japan
j Department of Surgery, Surgical Oncology and Science, Sapporo Medical University Hospital, Sapporo, Hokkaido, Japan
k Division of Breast and Endocrine Surgery, Tottori University Hospital, Yonago-city, Tottori, Japan
l Department of Medical Oncology, National Cancer Centre Hospital East, Kashiwa-city, Chiba, Japan
m Department of Surgery, Juntendo University Shizuoka Hospital, Izunokuni-city, Shizuoka, Japan
n Department of Pharmacy, National Hospital Organization Shikoku Cancer Centre, Matsuyama-city, Ehime, Japan
o Department of Breast Surgical Oncology, Tokyo Medical University, Shinjuku-ku, Tokyo, Japan
p Department of Surgery, Iwate Medical University, Morioka-city, Iwate, Japan
q Department of Breast Surgery, Juntendo University Nerima Hospital, Nerima-ku, Tokyo, Japan
r Faculty of Pharmacy, Juntendo University, Urayasu-city, Chiba, Japan
s Clinical Research and Trial Centre, Juntendo University Hospital, Bunkyo-ku, Tokyo, Japan
†Contributed equally as first authors
a Corresponding author
著者(日本語表記): 齊藤光江1)、飯原大稔2)、下川元継3)、宇田川涼子4)、常泉道子5)、二村学6)、石川裕子7)、緒方英昭8)、坂東裕子9)、島宏彰10)、細谷恵子11)、向原徹12) 、田中顕一郎13)、生田智基14)、河手敬彦15)、石田和茂16)、中井克也17)、魚森俊喬1)、九冨五郎1) 10)、尾関理恵1) 18)、柳澤尚武1) 19)
著者所属:1)順天堂大学大学院医学研究科乳腺腫瘍学、2) 岐阜大学医学部附属病院 薬剤部 3) 山口大学大学院医学系研究科医学統計学分野 4) 国立研究開発法人国立がん研究センター中央病院 5) 静岡県立総合病院乳腺外科 6) 岐阜大学医学部附属病院 乳腺外科 7) 順天堂大学医学部附属浦安病院 乳腺外科 8) 東邦大学医療センター大森病院 乳腺外科 9) 筑波大学附属病院 乳腺・甲状腺・内分泌外科 10) 札幌医科大学附属病院 消化器・総合、乳腺・内分泌外科11) 鳥取大学医学部附属病院 乳腺内分泌外科 12) 国立がん研究センター東病院 乳腺・腫瘍内科 13) 順天堂大学医学部附属静岡病院 外科14) 四国がんセンター 乳腺外科 15) 東京医科大学病院 乳腺科 16) 岩手医科大学附属病院 外科17) 順天堂大学医学部附属練馬病院 乳腺外科 18)順天堂大学 薬学部 19) 順天堂大学医学部 臨床研究・治験センター 臨床研究支援室
1)2)は共に1st author、1)はCorreponding author
DOI: https://doi.org/10.1016/S1470-2045(25)00233-5
本研究は、順天堂大学のCORE(The Capture of Outstanding Clinical Research and Evolution)projectに採択され、多施設との共同研究の基に実施されました。
本研究にご協力いただいた皆様には深謝いたします。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
