RyR1のCa2+誘発性Ca2+遊離は骨格筋の生理的な収縮に寄与しないことを証明
~半世紀にわたる論争に終止符~

順天堂大学医学部薬理学講座の小林琢也 助教、國廣(呉林)なごみ 客員准教授、小西眞人 客員教授、村山尚 先任准教授と東京慈恵会医科大学の山澤徳志子 教授、谷端淳 講師らの研究グループは、国立精神・神経医療研究センターとの共同研究により、1型リアノジン受容体(RyR1)の開口メカニズムの一つであるCa2+誘発性Ca2+遊離(CICR)*¹が、骨格筋の生理的な筋収縮には寄与しないことを明らかにしました。本研究では、CICRを選択的に抑制したモデルマウスを用いて、生理的な筋収縮が野生型マウスと同等であることを示しました。この成果は、骨格筋収縮におけるCICRの意義をめぐって半世紀にわたり続いてきた論争に終止符を打つものです。
本研究成果は、米国科学アカデミー紀要(Proceedings of the National Academy of Sciences of the United States of America)誌のオンライン版に2025年8月21日付で掲載されました。
本研究成果のポイント
● RyR1のCICRを選択的に抑制したモデルマウスを作出し解析を実施
● CICRは生理的な筋収縮には寄与せず、悪性高熱症の病態に関与することを証明
● 高齢化社会において健康寿命を延ばす新たなアプローチとしても注目
背景
リアノジン受容体(RyR)*²は筋小胞体(SR)*³膜上に存在するCa2+遊離チャネルであり、RyR1は骨格筋、RyR2は心筋において、それぞれ筋収縮に必要なCa2+を筋小胞体(SR)から供給します。両者はいずれも、Ca2+によってチャネルが開口するCa2+誘発性Ca2+遊離(CICR)活性を有し、心筋ではCICRによって筋収縮が引き起こされることが知られています。一方、骨格筋の生理的な筋収縮では、RyR1はT管膜のジヒドロピリジン受容体(DHPR)*⁴との相互作用を介して、脱分極誘発性Ca2+遊離(DICR)*⁵により開口します(図上)。しかし、RyR1はSR膜上に2列に整列しているのに対し、Cav1.1は市松模様状に配置されており、RyR1の半分としか相互作用していません(図上)。この構造的特徴から、DICRで開口するのはRyR1の半分のみで、残りのRyR1はDICRで遊離されたCa2+によりCICRによって開口する可能性、すなわち「CICRがDICRの増幅機構として機能する」という仮説が提唱されてきました(図上)。しかしこの説には賛否両論があり、半世紀にわたる論争が続いていました。
本研究では、CICRに必要なCa2+結合部位に変異を導入し、RyR1のCICRを選択的に抑制したモデルマウスを作出することで、生理的筋収縮におけるCICRの役割を検証しました。
内容
RyR1のCa2+結合部位はチャネルドメイン直上のセントラルドメインとC末端ドメインの境界に存在し、2つのグルタミン酸残基およびカルボニル酸素でCa2+を配位します。これらのグルタミン酸を非極性アミノ酸に置換するとCICR活性が失われることが知られており、本研究ではグルタミン酸E3896をアラニンに置換した変異モデルマウス(RyR1-E3896A、以下EAマウス)を作出しました。EAマウスはDICRは正常ですが、Ca2+が結合できないためにCICRは抑制されています(図中)。EAマウスは外見上の異常はなく、生殖能力も正常でした。驚いたことに、骨格筋収縮時のCa2+トランジエント、単離筋の発生張力、さらには生体マウスの筋力は、野生型マウスと同等でした。以上の結果は、RyR1によるCICRが生理的筋収縮には寄与していないことを示しています。したがって、「CICRがDICRの増幅機構として機能する」という仮説は明確に否定されました。
CICRは筋疾患である悪性高熱症(Malignant Hyperthermia, MH)への関与が示唆されています。MHは吸入麻酔薬により筋強直と高体温を引き起こす致死的疾患で、その主な原因はRyR1遺伝子の変異によるチャネル活性の異常亢進とされています。本研究グループは以前、MHモデルマウス(RyR1-R2509C、以下RCマウス)を作出し、このマウスがMH患者と同様に吸入麻酔により発作を起こして死亡することを報告しました(プレスリリース:https://www.juntendo.ac.jp/news/00151.html)。MHにおけるCICRの関与を検証するため、RCマウスとEAマウスを交配して得た複合ヘテロ接合マウス(RC/EAマウス)の性質を調べました。その結果、RC/EAマウスでは吸入麻酔による体温上昇が抑制され、生存率が著しく向上しました。この結果は、MHの発症にCICRが深く関与していることを示しています。
以上より、RyR1によるCICRは生理的筋収縮にはほとんど寄与しない一方で、MHの発症には関与していることが明らかとなりました(図下)。
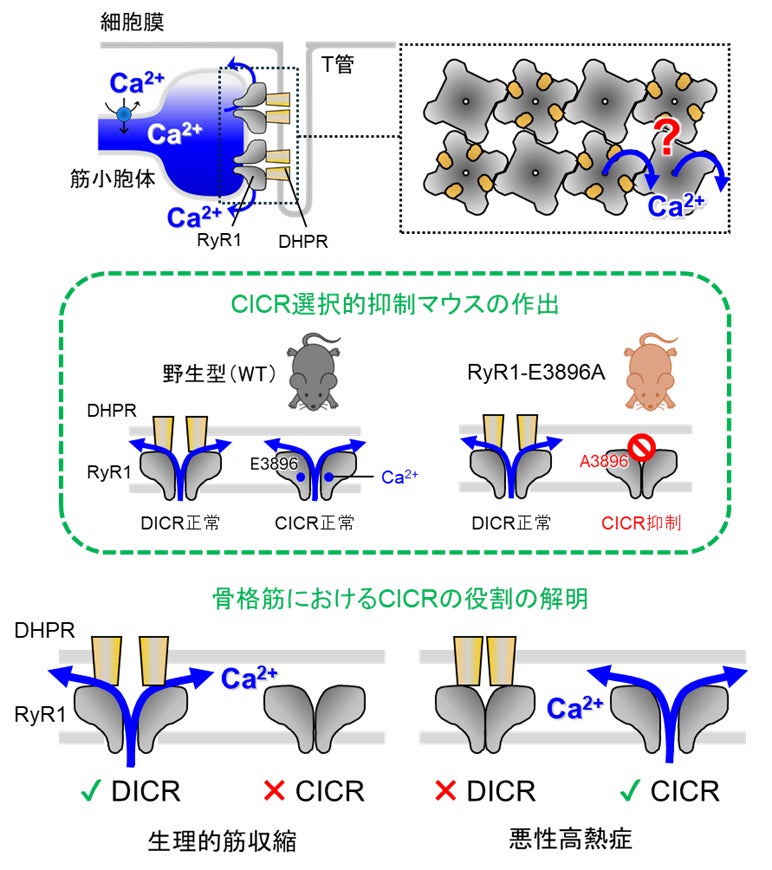
図.本研究で明らかになった骨格筋におけるCa2+遊離機構とCa2+誘発性Ca2+遊離(CICR)の役割.
(上)骨格筋では筋小胞体(SR)のCa2+遊離チャネルであるRyR1が開口して筋収縮に必要なCa2+を遊離する。RyR1はSR膜上に2列に配列し、一つ置きにT管膜のジヒドロピリジン受容体(DHPR)と相互作用する。生理的な筋収縮ではDHPRと相互作用したRyR1が脱分極誘発性Ca2+遊離(DICR)で開口する。この際、DHPRと相互作用していないRyR1がCICRによって開口してCa2+シグナルの増幅を起こす可能性が議論されていた(?マーク)。
(中)本研究ではRyR1のCa2+結合部位のグルタミン酸(E3896)をアラニンに置換した変異マウス(RyR1-E3896A)を作出した。野生型マウスはDICRとCICRの両方のモードで開口するのに対して、RyR1-E3896AマウスはDICRは正常に起こるが、Ca2+が結合できないためにCICRは抑制されている。
(下)本研究の結果、生理的な筋収縮ではCICRによるCa2+シグナルの増幅は起こらないことが分かった。悪性高熱症ではRyR1の異常活性化によるCa2+遊離が病態形成に関与すると考えられてきたが、CICRの関与が明確となった。
今後の展開
Ca2+は多様な役割を担うセカンドメッセンジャーであり、骨格筋においては筋収縮のみならず、筋の維持、筋線維タイプの決定、筋疲労、熱産生など、さまざまな現象に関与することが指摘されています。EAマウスでは体重、筋重量、筋線維タイプに差異は認められなかったことから、CICRがこれらの現象に寄与する可能性は低いと考えられます。今後は筋疲労や熱産生に関する研究を進めることで、骨格筋におけるCICRの意義の全貌が明らかになると期待されます。また、Ca2+は筋萎縮やサルコペニアといった加齢関連病態にも関与することが知られています。CICRの活性化は筋疾患を増悪すると考えられるため、CICRの適切なコントロールは高齢化社会において健康寿命を延ばす新たなアプローチとしても注目されます。
用語解説
*1 Ca2+誘発性Ca2+遊離(CICR):Ca2+の結合により起こる開口モード。すべてのRyRサブタイプが有する。
*2 リアノジン受容体(RyR):小胞体膜のCa2+遊離チャネル。哺乳類には3種類のサブタイプ(RyR1-3)が存在する。RyR1は骨格筋、RyR2は心筋、RyR3は非筋細胞に発現する。
*3 筋小胞体(SR):骨格筋および心筋細胞内にある小胞体。Ca2+の貯蔵庫としてはたらく。
*4 ジヒドロピリジン受容体(DHPR):T管膜の電位依存性Ca2+チャネル。骨格筋では電位センサーとしてはたらく。
*5 脱分極誘発性Ca2+遊離(DICR):T管膜の脱分極によるDHPRとRyR1の相互作用を介する開口モード。RyRサブタイプのうちRyR1のみが有する。
原著論文
本研究はProceedings of the National Academy of Sciences of the United States of America誌のオンライン版に2025年8月21日付で公開されました。
タイトル:RyR1-mediated Ca2+-induced Ca2+-release plays a negligible role in excitation-contraction coupling of normal skeletal muscle.
タイトル(日本語訳): RyR1のCa2+誘発性Ca2+遊離は正常な骨格筋の興奮収縮連関においてごく僅かな役割しか果たしていない。
著者:Takuya Kobayashi 1), Toshiko Yamazawa 2), 3)*, Nagomi Kurebayashi 1), Masato Konishi 1), Jun Tanihata 4), Masami Sugihara 5), Yoshifumi Miki 2), Satoru Noguchi 6), Yukiko U. Inoue 7), Takayoshi Inoue 7), Takashi Sakurai 1), Takashi Murayama 1)*, *Corresponding author
著者(日本語表記):小林 琢也1)、山澤 徳志子2), 3)、呉林 なごみ1)、小西 眞人1)、谷端 淳4)、杉原匡美5)、三木 祥史2)、野口 悟6)、井上 (上野) 由紀子7)、井上 高良7)、櫻井 隆1)、村山 尚1)* *共同責任著者
著者所属:1)順天堂大学医学部薬理学講座、2)東京慈恵会医科大学総合医科学研究センター基盤研究施設、3)、東京慈恵会医科大学安定同位体医学応用研究センター、4)東京慈恵会医科大学分子生理学、5) 順天堂大学大学院医学研究科臨床検査医学、6)国立精神・神経医療研究センター神経研究所、7) 国立精神・神経医療研究センター病態生化学研究部
DOI: https://doi.org/10.1073/pnas.2500449122
本研究はJSPS科研費JP20K11368, JP23K10692, JP22H05055, JP23K18453, JP23K24778, JP25K03053, JP19K07105, JP22K06652, JP23K08684, JP23K24067, JP25K02443をはじめとした多くの支援を受け、多施設共同研究として実施されました。
本研究にご協力いただいた皆様に深謝いたします。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
