がんの細胞死を制御するタンパク質の新たなしくみを解明~HDM2をターゲットとした新たな抗がん剤開発への応用に期待~
研究グループは核磁気共鳴(NMR)法(注2)と分子動力学(MD)シミュレーション(注3)を用いた解析により、HDM2にはこれまで知られていなかった構造平衡が存在すること、また、ストレス応答によるHDM2のリン酸化はこの構造平衡を変化させることでp53との結合を抑制することを明らかにしました。
HDM2は抗がん剤の標的分子として注目されており、本研究で明らかになったHDM2の立体構造情報は、p53との相互作用を阻害する新規薬剤の創出に貢献することが期待されます。
本研究成果は2024年3月29日(日本時間)に米国化学会誌Journal of the American Chemical Societyに掲載されました。
研究の背景
HDM2はがん抑制因子p53を標的とするE3ユビキチンリガーゼ(注4)であり、通常時はp53に結合して分解を誘導することでp53によるアポトーシス(細胞死)を回避しています。一方で細胞ストレスによりDNAが損傷すると、その応答としてHDM2の17番目のセリン(S17)残基がリン酸化され、p53の結合が抑制されます。その結果、p53によるアポトーシスが起きることで細胞のがん化を防ぎます。
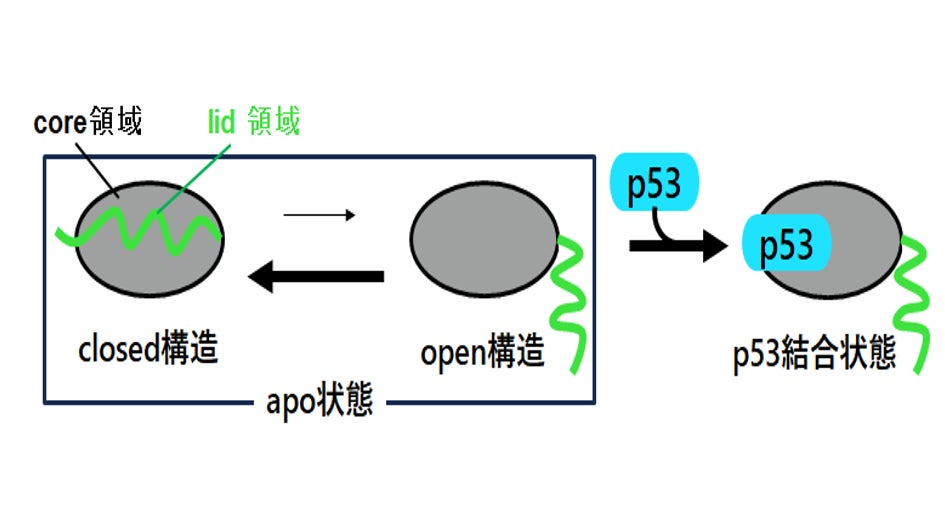 図1:apo状態(p53非結合状態)のHDM2において従来考えられていたopen-closed間の構造平衡
図1:apo状態(p53非結合状態)のHDM2において従来考えられていたopen-closed間の構造平衡
これまでの構造解析からHDM2はN末端に存在する”lid”領域とp53が結合できる”core”領域から構成され、lidがcoreから解離したopen構造と、lidがcoreと結合したclosed構造の2状態間での動的な構造平衡状態にあることが知られています(図1)。このlid領域が形成する構造平衡とHDM2によるp53の結合制御は密接な関係にあると考えられていますが、その具体的な構造や、リン酸化がp53との結合を抑制するメカニズムは不明なままでした。
研究手法と成果
 図2: (a)側鎖メチル基のNMRスペクトルの温度依存的な変化 (b)NMRスペクトルから推測されるmulti-stateな構造平衡
図2: (a)側鎖メチル基のNMRスペクトルの温度依存的な変化 (b)NMRスペクトルから推測されるmulti-stateな構造平衡
研究グループはまず水溶液中におけるタンパク質の構造を解析できるNMR法を用いてHDM2の動的構造情報の取得を試みました。
その結果、HDM2内でのopen-closed間における遅い交換速度(slow exchange)の構造平衡に加えて、closed構造の内部において速い交換速度(fast exchange)の構造平衡が存在することが分かりました(図2a)。
このことから、HDM2は二つのclosed状態と一つのopen状態を含む複数状態(multi-state)の間の構造平衡を形成することが明らかになりました(図2b)。
次に、研究グループはmulti-stateな構造平衡を形成するHDM2の各状態の具体的な構造を明らかにするために、MDシミュレーションを実施しました。その結果、lidがcoreから解離した複数のopen構造に加えて、lidがcoreと近接した二つのclosed構造(closed 1, closed 2)が得られました(図3a, b)。これら二つの構造は19番目のイソロイシン(I19)と100番目のチロシン(Y100)の位置関係が異なっており、NMRスペクトルのI19シグナルの挙動を良く説明するものでした(図3c, d)。また、closed 1構造はclosed 2構造よりもopen構造に遷移しにくいと推測されることから、closed 1-closed 2平衡のうち、closed 2構造を介してopen構造へ遷移する構造平衡モデルを提唱しました(図4a)。さらに、S17のリン酸化はclosed 1構造の存在割合を増加させ、p53との結合を抑制することも明らかとなりました(図4b)。
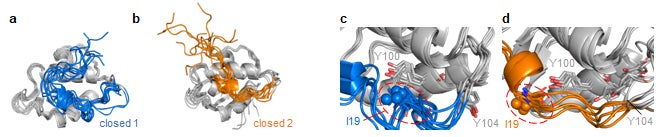 図3:MDシミュレーションから得られたclosed 1(a), closed 2(b)の重ね合わせ構造。 closed 1(c), closed 2(d)のI19-Y100側鎖近傍の構造。
図3:MDシミュレーションから得られたclosed 1(a), closed 2(b)の重ね合わせ構造。 closed 1(c), closed 2(d)のI19-Y100側鎖近傍の構造。
以上の結果を踏まえて、研究グループはHDM2のmulti-stateな構造平衡について、通常時ではopen構造のHDM2がp53と結合し分解を促進するのに対し、細胞ストレスに応じたS17リン酸化によってopen構造へ遷移しにくいclosed 1構造が安定化することでopen構造の存在量が減少し、分解を逃れたp53により細胞のアポトーシスが進行するという、新しいp53によるアポトーシス誘導の制御機構を提唱しました(図4)。
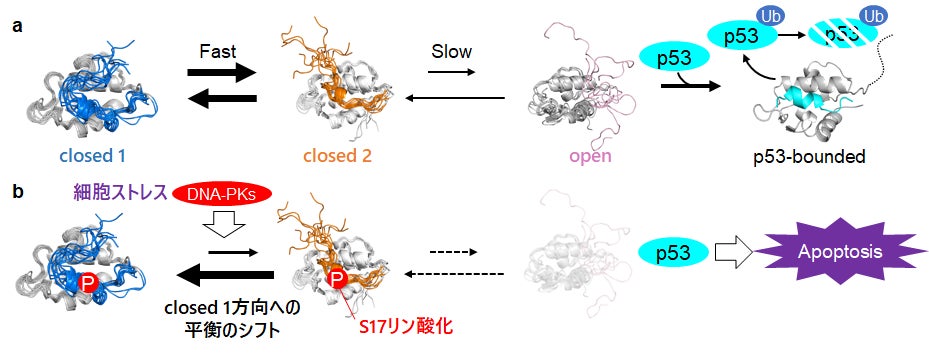 図4:本研究で明らかになったHDM2のmulti-stateな構造平衡を介したp53結合制御モデル
図4:本研究で明らかになったHDM2のmulti-stateな構造平衡を介したp53結合制御モデル
今後の展望
本研究ではNMR法とMDシミュレーションを用いることで、HDM2がmulti-stateな構造平衡状態にあることと、各状態の原子レベルでの構造を明らかにしました。また、lidに含まれるS17残基のリン酸化はclosed 1構造の安定化を引き起こし、open構造への遷移が起きにくくなることを明らかにしました。HDM2は抗がん剤開発の標的の一つであることから、今後新たな抗がん剤の開発に向けて本研究で得られた成果の活用が期待されます。
用語解説
注1) がん抑制因子p53:転写因子としてゲノムDNAと結合することで、細胞増殖の停止・DNA修復・アポトーシス等に関わる遺伝子を発現させる機能をもつタンパク質。
注2) 核磁気共鳴(NMR)法:静磁場中にある原子核に電磁波を照射したときに、原子核がそれぞれの化学的環境に応じた特定の周波数で生じる共鳴現象を観測することでタンパク質など生体分子を含めた物質の構造や運動性を解析する手法。
注3) 分子動力学(MD)シミュレーション:原子間に働く力を計算し、ニュートンの運動方程式を繰り返し解くことで、分子の運動を追跡する方法。
注4) E3ユビキチンリガーゼ:特定の標的に結合し、E2ユビキチン結合酵素を介して標的へユビキチン分子を転移(ユビキチン化)するタンパク質。細胞内でユビキチン化された標的分子はプロテアソームによる分解を受ける。
論文情報
タイトル:Deciphering the multi-state conformational equilibrium of HDM2 in the regulation of p53 binding: Perspectives from molecular dynamics simulation and NMR analysis
著者:Kazuki Watanabe, Qingci Zhao, Ryosuke Iwatsuki, Ryota Fukui, Weitong Ren, Yuji Sugita, and Noritaka Nishida
雑誌名:Journal of the American Chemical Society
DOI:https://doi.org/10.1021/jacs.3c14383
研究プロジェクトについて
本研究は文部科学省・科研費学術変革領域研究A「細胞内分子構造動態を解明するためのクロススケールIn-cell NMR解析」(21H05250)、科学技術振興機構(JST)CREST「インセルNMR計測による細胞内蛋白質の構造・動態・機能解明」(JPMJCR21E5)の支援により遂行されました。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
