SARS-CoV-2のゲノム合成に対するRNA損傷の影響を解明~酸化ストレスはウイルス複製の障害か、それとも変異の原動力か?~
千葉大学大学院理学研究院の佐々彰准教授と同大融合理工学府博士後期課程2年の赤川真崇氏は、神戸大学バイオシグナル総合研究センターの菅澤 薫教授との共同研究で、活性酸素種(ROS)(注1)によるRNA(注2)の損傷が、新型コロナウイルス(以下、SARS-CoV-2)のゲノムRNA(注3)の複製反応を妨げ、突然変異を引き起こすメカニズムを世界で初めて解明しました。
本研究により、酸化ストレスはSARS-CoV-2のゲノムRNA複製を妨げる障害要因であると同時に、変異を促進する要因にもなり得ることが示唆されました。本研究は、RNAの酸化がSARS-CoV-2のゲノム変異を引き起こすメカニズムを明確に示した初めての報告であり、RNAウイルスの変異予測や新たな抗ウイルス治療法の開発に貢献することが期待されます。
本研究成果は、米国科学雑誌Journal of Biological Chemistryにて4月16日に公開されました。
■研究の背景
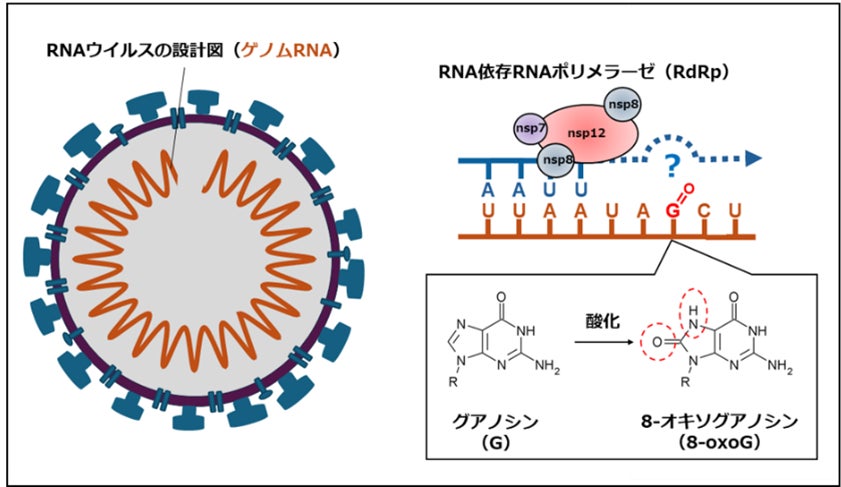
生物のゲノムはDNAから構成されますが、一部のウイルスはRNAをゲノムに持ちます。RNAの塩基配列は、アデノシン(A)(注4)、シチジン(C)(注5)、グアノシン(G)(注6)、ウリジン(U)(注7)の4つのヌクレオシドから成り立っています。しかしRNAウイルスのゲノムには、RNA配列が書き換わる「突然変異」が頻繁に生じることが知られており、これがワクチンや抗ウイルス薬の開発を難しくする要因となっています。SARS-CoV-2は、一本鎖のRNAをゲノムとして持ち(図1)、これまでに①C → U、②G → U、③A → Gといった突然変異が報告されています。このうち、①C → Uと③A → Gの変異は、宿主細胞内に存在するRNA編集酵素の働きによって生じることが明らかになっています。しかし、②G → Uの変異がどのようにして生じるのかは、これまで不明でした。
ウイルス感染によって、宿主の細胞では活性酸素種(ROS)の産生が増加することが知られています。ROSは細胞内のさまざまな分子に酸化損傷を与えることから、ウイルスRNAに対しても損傷を引き起こす可能性があります。しかし、こうしたRNAの酸化損傷がウイルスの突然変異にどのように関与するのかについては、これまでほとんど研究が行われていませんでした。
■研究の成果
SARS-CoV-2のゲノムRNAの複製は、ウイルス由来の酵素である「RNA依存RNAポリメラーゼ(以下、RdRp)(注8)」が担っています(図1)。RdRpは、既存のゲノムRNAを鋳型とし、Aに対してU、Gに対してCを取り込むことで相補的なRNAを新たに合成します。本研究では、ROSによる主要なRNA損傷であるグアノシン(G)の酸化により生じる8-オキソグアノシン(8-oxoG)に着目し、RdRpが8-oxoGを鋳型とした際のRNA合成の挙動や変異誘発メカニズムを解析しました。
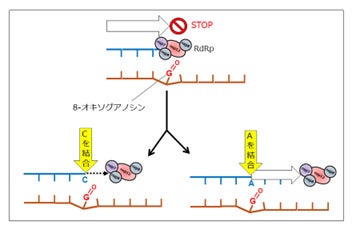
SARS-CoV-2のRdRpは、ウイルスが持つ3種類のタンパク質—nsp7(1分子)、nsp8(2分子)、nsp12(1分子)—の計4分子が結合した複合体として機能します。本研究では、遺伝子組換え大腸菌を使って発現・精製してSARS-CoV-2のRdRp複合体を再構成し、人工的に化学合成した8-oxoGを含むRNAを鋳型として、試験管内でRNA合成反応を再現しました。その結果、8-oxoGはRdRpの酵素活性を著しく阻害し、RdRpは8-oxoGの直前でRNA合成を停止することが分かりました。これは、ROSによるRNAの酸化がSARS-CoV-2の複製を強く阻害する要因になり得ることを示しています。一方で、一部のRdRpは8-oxoGを乗り越えてRNA合成を再開することが観察されました。
さらに詳細に解析したところ、RdRpが8-oxoGに対して正しいヌクレオシドであるCを取り込んだ場合は再び反応が停止する(図2左下)のに対し、誤ったヌクレオシドであるAを取り込んだ場合にはRNA合成を継続できることが分かりました(図2右下)。その結果、新たに合成されたRNAでは、CよりもAが7倍高い頻度で誤って取り込まれていたことが判明しました。次のRNA複製の過程でAに対してはUが取り込まれるため、最終的にRNA配列がG → Uに変異することになります。本研究により、RNAの酸化がSARS-CoV-2の複製に及ぼす影響がはじめて明確になりました。
■今後の展望
本成果は、ウイルスゲノムの変異メカニズムに新たな視点を提供し、今後の変異予測や抗ウイルス戦略の開発への貢献が期待されます。例えば、RNAの酸化レベルを調節する低分子化合物がSARS-CoV-2のゲノム複製に影響を与え、新規治療法として応用できる可能性が考えられます。一方で、ROSの増加がRNAウイルスの増殖を促進するとの報告もあるため、ROSがウイルスに与える影響については慎重な評価が必要です。今後、ウイルスにおけるゲノム損傷応答のメカニズムを解明することで、より効果的な抗ウイルス戦略の開発につながることが期待されます。
■用語解説
注1)活性酸素種(ROS):Reactive Oxygen Speciesの略称で、酸素分子が部分的に還元されて生じる反応性の高い分子種の総称。これらは細胞内のミトコンドリアにおけるエネルギー代謝や、炎症反応、紫外線・放射線照射、化学物質の曝露などによって生じる。
注2)RNA:「リボ核酸」の略称で、DNA(デオキシリボ核酸)と同様に生体内での遺伝情報の伝達や発現に関わる分子である。
注3)ゲノムRNA:ウイルスのなかでも特にRNAウイルスにおいて、遺伝情報を担うRNA分子のことを指す。ゲノムRNAはウイルス粒子の中に封入されており、感染後は宿主細胞内でウイルス自身の複製やタンパク質合成に使われる。
注4)アデノシン(A):塩基のアデニンと糖(以下、リボース)が結合した構造を持つ。
注5)シチジン(C):塩基のシトシンとリボースが結合した構造を持つ。
注6)グアノシン(G):RNAを構成する4種類のヌクレオシドの一つ。グアノシンの8位の炭素原子に酸素が付加されることで8-オキソグアノシンが生成される。
注7)ウリジン(U):塩基のウラシルと糖(リボース)が結合した構造を持つ。
注8)RNA依存RNAポリメラーゼ(RdRp):RNAを鋳型としてRNAを合成するタンパク質。おもにRNAウイルスが保有しており、RNAウイルスの複製に必要不可欠な酵素である。RdRpは宿主細胞には通常存在せず、ウイルスが自らの複製に利用する点で、抗ウイルス薬の標的にもなっている。
■研究プロジェクト
本研究は、以下の支援を受けて実施されました。
• 神戸大学バイオシグナル総合研究センター 共同利用研究 201015
• 科学技術振興機構 A-STEPトライアウトタイプ JPMJTM20L8
• 日本学術振興会 科学研究費助成事業 基盤研究(B) 22H03748
• 興和生命科学振興財団 研究助成
■論文情報
タイトル:Impact of an oxidative RNA lesion on in vitro replication catalyzed by SARS-CoV-2 RNA-dependent RNA polymerase
著者:Masataka Akagawa, Kaoru Sugasawa, Kiyoe Ura, Akira Sassa
雑誌:Journal of Biological Chemistry
DOI:10.1016/j.jbc.2025.108512
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
