ペプチド医薬品開発のひむかAMファーマ、オーストラリアでの臨床試験を終了
開発品HM201での最初のヒト投与試験を終了し、まもなくデータを受領
指定難病の潰瘍性大腸炎などに向けたペプチド(アミノ酸の結合体)医薬品を開発する、ひむかAMファーマ株式会社(本社・宮崎市、以下ひむかAM)は、ひむかAMのオーストラリア子会社Himuka AM Australia Pty. Ltd. が、開発品「HM201」の第I相臨床試験の終了報告をオーストラリア薬品・医薬品行政局(Therapeutic Goods Administration)に提出したことを発表しました。HM201は投与の利便性を格段に向上させた新薬候補品です。
■開発品HM201
HM201の主成分は、ひむかAMの共同創業者である北村和雄(宮崎大学特別教授)が発見したペプチド「アドレノメデュリン(AM)」をベースに新規開発されました。
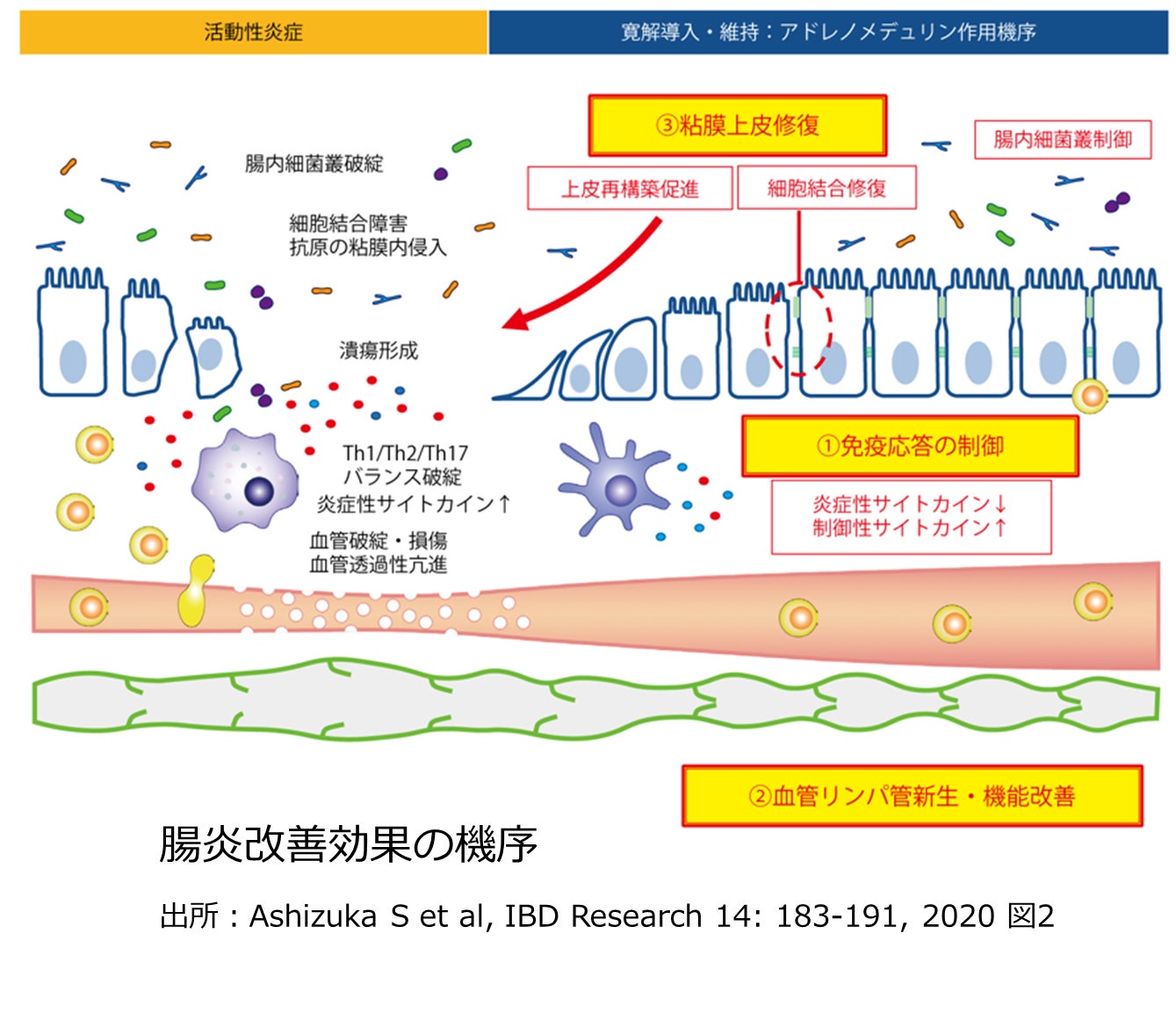
AMは上皮細胞のバリア機能の修復・維持に関わる物質です。慢性炎症により傷んだ腸粘膜の修復を促進します(右図参照)。また、AMは、抗炎症・免疫抑制を主作用とする医薬品とはたらき(機序)が異なるため、副作用リスクが低い特長も備えています。
■臨床試験
今回の臨床試験は、オーストラリアにおいて、第I相臨床試験として実施されました。健常な方を被験者として、HM201を単回又は複数回投与し、HM201の安全性や薬物動態等を確認することを目的とする試験です。
結果速報では評価項目に関して良好なデータが得られており、数ヶ月以内に最終報告を受領する予定です。
ひむかAM 代表取締役の新城裕司は次のようにコメントしました。「HM201は炎症性腸疾患での粘膜治癒を実現し得る開発品です。COVID-19パンデミックや治験実施地での天災等によって治験の進捗は影響を受けましたが、被験者・治験実施施設・CROの協力により治験を完了することができました。私たちはこの薬剤の臨床使用の実現に向け、今後も全力で取り組みます。」
■会社概要
社名:ひむかAMファーマ株式会社
事業:新規創薬シーズの研究開発、ライセンシング
設立:2017年2月1日
所在地:〒880-0812 宮崎県宮崎市高千穂通2丁目5番36号
Webサイト: https://www.himuka-am.com/
宮崎大学発ベンチャー企業
J-Startup企業
HM201の主成分は、ひむかAMの共同創業者である北村和雄(宮崎大学特別教授)が発見したペプチド「アドレノメデュリン(AM)」をベースに新規開発されました。
AMは上皮細胞のバリア機能の修復・維持に関わる物質です。慢性炎症により傷んだ腸粘膜の修復を促進します(右図参照)。また、AMは、抗炎症・免疫抑制を主作用とする医薬品とはたらき(機序)が異なるため、副作用リスクが低い特長も備えています。
HM201は、AMの投与における利便性を大幅に向上させることを目的に開発されました。
■臨床試験
今回の臨床試験は、オーストラリアにおいて、第I相臨床試験として実施されました。健常な方を被験者として、HM201を単回又は複数回投与し、HM201の安全性や薬物動態等を確認することを目的とする試験です。
結果速報では評価項目に関して良好なデータが得られており、数ヶ月以内に最終報告を受領する予定です。
ひむかAM 代表取締役の新城裕司は次のようにコメントしました。「HM201は炎症性腸疾患での粘膜治癒を実現し得る開発品です。COVID-19パンデミックや治験実施地での天災等によって治験の進捗は影響を受けましたが、被験者・治験実施施設・CROの協力により治験を完了することができました。私たちはこの薬剤の臨床使用の実現に向け、今後も全力で取り組みます。」
■会社概要
社名:ひむかAMファーマ株式会社
事業:新規創薬シーズの研究開発、ライセンシング
設立:2017年2月1日
所在地:〒880-0812 宮崎県宮崎市高千穂通2丁目5番36号
Webサイト: https://www.himuka-am.com/
宮崎大学発ベンチャー企業
J-Startup企業
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
