病理組織標本における胃印環細胞癌の検出が可能なAIの開発に成功(深層学習を活用)~Technology in Cancer Research and Treatment誌に掲載~

■本研究成果の概要
胃内視鏡生検病理組織デジタル標本における印環細胞癌を検出する人工知能の開発に成功しました。
■本研究の背景
胃がんが臨床的に疑われた場合、「がんであるかどうかを確定するための検査」を行います。その検査方法のひとつが、内視鏡検査です。内視鏡検査で胃の内部を見て、がんなど病変が疑われる箇所があると、その箇所を摘んで組織を採取し、病理検査で胃がんかどうかを確定します(内視鏡生検)。他の臓器と比較し、胃に高頻度でみられる印環細胞癌は、細胞質内に貯留した粘液が細胞核を辺縁に圧排する細胞形態が特徴的であり、癌細胞が印環のように見えることから「印環細胞癌」と呼ばれています。胃印環細胞癌の予後に関して、特に、胃の粘膜下層以下に浸潤した癌では、硬性癌(スキルス胃癌)となって発見される例が多く、リンパ節への転移や、腹膜への播種、癌性リンパ管症などを伴い予後が不良とされます。
今回の研究の目的は、胃内視鏡生検病理組織デジタル標本において、印環細胞癌の検出を可能にする人工知能を深層学習を用いて開発することにあります。
■本研究の内容
本研究では広島大学および国際医療福祉大学三田病院より胃内視鏡生検病理組織標本の提供を受け、標本をデジタル化したのちに、深層学習のための教師データを複数の病理医が作成し、深層学習を行うことで人工知能を開発しました。開発した人工知能は、広島大学・国際医療福祉大学三田病院およびDigestPath2019から提供をうけたデジタル標本を検証症例として用い、精度の検証を行いました。
■本研究の成果
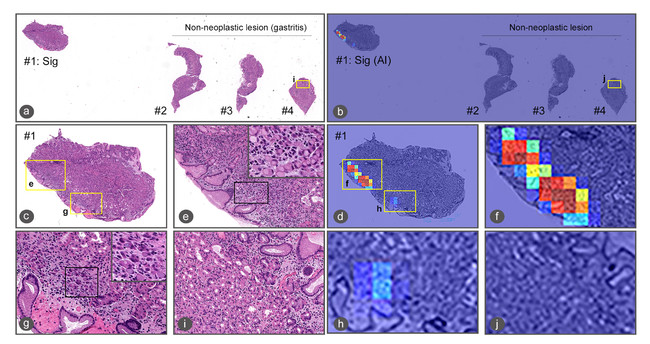
学習方法や倍率を変えた複数の人工知能モデルを開発しましたが、いずれの検証症例においても、印環細胞癌の検出において、ROC-AUCが0.99という極めて高い精度の結果が得られました。また、ヒートマップにより表示された人工知能が検出した印環細胞癌を示唆する領域は、病理医による検証の結果、妥当であることが確認されました。
以上、胃内視鏡生検病理組織デジタル標本において、精度高く印環細胞癌を検出する人工知能の開発に成功しました。
昨年より発表してきた胃・大腸・肺・膵臓に関する人工知能開発の論文に続いて、胃印環細胞癌を検出することが可能になりました。今回開発した人工知能モデルの精度を、複数施設で今後検証する予定です。
■ 共同研究者のコメント ~ 本研究の意義と今後の展望について ~
札幌厚生病院 病理診断科 主任部長
市原 真
胃のいわゆる未分化型癌(Nakamura K, et al. 1968)に分類される印環細胞癌の判別が可能となったことは、臨床診療的にも病理診断的にも大きなインパクトを持ちます。なぜなら、本研究によって今後、胃癌の人工知能解析においては「癌細胞がここにある」と認識する単純な存在診断ではなく、「ここにある癌が高分化型管状腺癌なのか、それとも印環細胞癌なのか」と弁別する=組織型分類ごとにマッピングを塗り分けることが可能になると期待されるからです。
現在、早期胃癌(癌が粘膜下層までの浸潤に留まっている癌)の層別化診療においては、印環細胞癌の成分を的確に見分けてマッピングすることが極めて重要です。内視鏡的粘膜下層剥離術(endoscopic submucosal dissection: ESD)によって治療された検体は、全例に病理診断が施行されますが、このとき、癌の組織型に未分化型(印環細胞癌、低分化腺癌、粘液癌)の成分がどれだけ含まれているかによって、その後の治療方針が変わります(胃癌治療ガイドライン第5版.日本胃癌学会編,金原出版,東京,2018)。
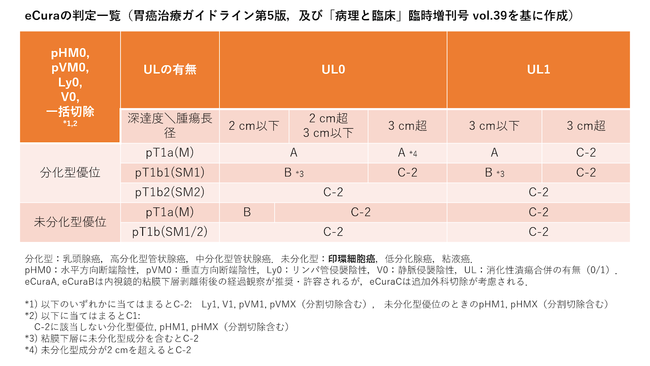
図1.内視鏡治療の根治判定(eCura)の基準表
これに基づき、病理診断の現場では、ESD標本において印環細胞癌をはじめとする未分化型成分がどれだけ病変内に含まれているかを、複数枚のプレパラートすべてにおいてマッピングし、未分化型成分の総量と長径を記載しなければいけません。この作業は病理診断の現場に膨大な負担をかけます。

図2.胃癌を分化度ごとにマッピングした1例.非常に小範囲であるが未分化型癌成分が混在している.合計34枚のプレパラートについて人力で詳細なマッピングを施行したが、多大な労力を必要とする。
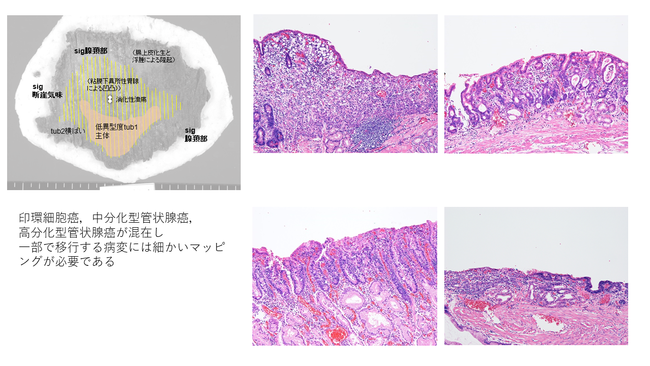
図3.胃癌を分化度ごとにマッピングした1例.印環細胞癌を含む多彩な組織像が病変内に混在して見受けられる.印環細胞癌領域の面積などのファクターによって追加外科手術が考慮される(本例では追加外科手術が施行された)。
胃癌の二大組織型である分化型と未分化型を、人工知能診断が双方カヴァーして「塗り分ける」ことは、病理診断の労力軽減、精度向上に大きく寄与し、胃癌診療の方針決定シークエンスにおいて強力なツールとなることでしょう。
現在、胃癌に限らず多くのがんで「病変内の多様性」が観察され、その一部は患者予後に影響することがわかってきています(参考:治療方針を変える病理所見 診療ガイドラインと治療戦略.病理と臨床臨時増刊号.2021,vol.39,東京,文光堂)。しかし、組織所見の多彩さのあまり、人力ではもはやマッピング・塗り分けが困難と感じる場面も多く経験されます。今回、分化度の低い癌腫をマクロファージや正常断片化細胞と精度高く弁別しながらヒートマップ表示できたことで、この先あらゆる癌腫において低分化な癌腫成分をはじめとする病変内多様性がマッピング可能になるのではないかと期待されます。人工知能による病理診断支援を、「がんのある・なし」を越えた次のステージに飛躍させるだけのポテンシャルを持った研究成果であると考えます。
■原著論文
本研究成果は、Technology in Cancer Research and Treatmentで公開されました。
▼論文タイトル:Deep learning models for gastric signet ring cell carcinoma classification in whole slide images Technology in Cancer Research & Treatment
▼日本語訳:病理組織デジタル標本における胃印環細胞癌の検出を可能にする深層学習を用いた人工知能の開発
▼DOI:https://doi.org/10.1177/15330338211027901
■著者・所属
<広島大学病院 病理診断科 教授>
有廣 光司
<札幌厚生病院 病理診断科 主任部長>
市原 真
<メドメイン株式会社>
飯塚 統、常木 雅之、Fahdi Kanavati、 Michael Rambeau
■会社概要
【会社名】メドメイン株式会社 (Medmain Inc.)
※経済産業省 J-START UP 選出企業 https://www.j-startup.go.jp/startups/
【設立日】2018年1月11日
【事業内容】医療ソフトウェア・クラウドサービスの企画・開発・運営および販売
【代表取締役/CEO】飯塚 統
【所在地】[東京オフィス] 東京都港区南青山2-10-11 A青山ビル2F / [福岡オフィス] 福岡県福岡市中央区赤坂2-4−5 シャトレサクシーズ104
■各種関連サイト
【コーポレートサイト】https://medmain.com/
【プロダクトサイト】https://medmain.com/products
- デジタル病理診断支援ソリューション「PidPort」
-「Imaging Center」~病理組織標本の高品質デジタル化サービス~
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
