バイオ・ナノフォトニクスのためのUPCナノ粒子の合成と機能化【産技助成Vol.30】
独立行政法人新エネルギー・産業技術総合開発機構
東京理科大学基礎工学部
細胞内の物質移動を可視化する蛍光バイオイメージングは
バイオテクノロジーやバイオメディカル分野のためのキーテクノロジーといわれている。
新開発の蛍光マーカーは、長時間かつ深度が深い観察を可能にするとともに
「からだにやさしいバイオイメージング」を実現する。
東京理科大学基礎工学部
細胞内の物質移動を可視化する蛍光バイオイメージングは
バイオテクノロジーやバイオメディカル分野のためのキーテクノロジーといわれている。
新開発の蛍光マーカーは、長時間かつ深度が深い観察を可能にするとともに
「からだにやさしいバイオイメージング」を実現する。
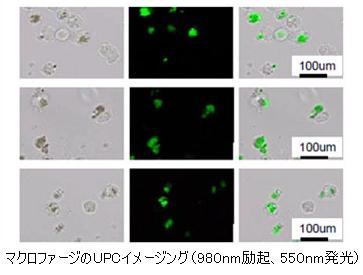
独立行政法人新エネルギー・産業技術総合開発機構(NEDO技術開発機構)の産業技術研究助成事業(予算規模:約50億円)の一環として、東京理科大学基礎工学部の准教授、曽我公平氏は、UPCナノ粒子の合成と機能化によって、安全性の高い近赤外光励起の蛍光マーカーを開発し、細胞内の物質移動の長時間かつ深度の深い観察を可能にしました。
従来の紫外光励起による蛍光バイオイメージングでは退色、光毒性、光散乱といった問題が懸念されていましたが、それらを一気に解決します。UPC発光ナノ粒子は生理環境下で高い分散安定性を示し、ターゲットとするタンパク質に特異的に吸着します。また、希土類のイオン種、Er(エルビウム)、Tm(ツリウム)、Pr(プラセオジウム)を変えることで赤、緑、青の発光プローブの用意を可能にし、カラーラベリングも容易に行えます。
励起に用いる980nmのレーザーは半導体赤外レーザーで行えるため、ハンドリングが容易で、スペースを取りません。また、蛍光発光は可視光なので、現在広く用いられているCCDやフィルターをそのまま使用できるので、コストパフォーマンスにも優れています。
1.研究成果概要
生命現象を高感度、多色、動画によって可視化する蛍光バイオイメージングは、細胞工学をはじめとするバイオテクノロジー、医療分野における予防・診断・治療のための重要技術と言われています。励起光源に近赤外光を用いるメリットとしては、蛍光マーカーと生体組織へのダメージ軽減のみならず、紫外光や短波長可視光を励起光源とした場合に問題となる光散乱が軽減できること等も挙げられます。これにより、視野深度を拡大できるため、3次元的なバイオイメージングに有利となります。
本研究開発ではまず、効率よくアップコンバージョン発光を示し、かつ10〜200nmで均一に粒径が制御されたUPC発光ナノ粒子の合成を行いました。次に、得られた粒子上に二層の高分子で修飾を施すことにより、ターゲットのみに特異的に吸着する特異吸着能を付与しました。実験の結果、UPC発光ナノ粒子は980nm励起でアップコンバージョン発光を示し、分散安定型と特異吸着性を有する優れたバイオイメージングプローブであることが証明されました。
2.競合技術への強み
(1) 現在、広く行われている蛍光バイオイメージングでは、マーカーに蛍光タンパク質に代表される有機系蛍光体を用いています。しかし、その多くは紫外線を励起光とするため、紫外線の高い量子エネルギーにより有機蛍光体自体が分解し、数十秒以内で退色してしまうこと、色素以外の生体組織も紫外線のダメージを受けること、さらにマーカー以外の物質(特に生体を構成するたんぱく質をはじめとする有機物質)が発する自家蛍光がバックグラウンドとして観察されてしまうなどの問題があります。
(2) これらを解決するため、近赤外光(NIR)を励起光源とする蛍光マーカーの開発が1990年代後半より盛んに行われましたが、発光効率と耐久性の問題から有機分子系では実用的なものは得られていません。一方、励起光源に非紫外線である短波長可視光を用いる半導体量子ドット(無機系蛍光体をナノ粒子化したもの)の登場は退色の問題をある程度解決し、数十分の観察が可能となりましたが、水環境中におけるそれ以上の長い観察は難しく、さらに直接遷移型半導体に特有の元素毒性が問題となります。強い光散乱による観察深度の低下や、自家蛍光がバックグラウンドを招くことも解決課題とされ、長波長の近赤外光で励起する蛍光マーカーの開発が望まれていました。
(3) 本研究開発ではアップコンバージョン(UPC)と呼ばれる赤外—可視変換現象(注1)を用いて励起光源を近赤外光に変えることにより、以上のような問題点を解決し、現在よりもはるかに長時間かつクリアな、深い観察深度での蛍光バイオイメージングを可能としました。
(注1)蛍光は紫外線や可視光線が照射され、蛍光物質がそのエネルギーを吸収することで電子が励起し、それが基底状態に戻る際に余分なエネルギーを電磁波として放出する現象。蛍光灯は、低圧水銀灯の内側面に水銀の発する紫外線を吸収し、蛍光として可視光線を発する物質を塗布したものである。このように通常、蛍光は入射光線と同一あるいはより長波長の電磁波(エネルギーが低い電磁波)が放出されるが、UPC発光は赤外光を照射し、2段階以上、上のエネルギー状態に励起することで入射光線よりも短波長の(エネルギーが高い)可視光を発光させることができる技術である。
3.今後の展望
現段階では、がん細胞可視化のための細胞表面イメージングには成功していますが、細胞中の現象を解明するためには粒子サイズを50nm以下に抑える必要があります。よって、このサイズでの粒子合成、凝集沈降の抑制と粒子表面修飾が今後の検討課題となります。また、プローブを簡便に使えるマーカーとしてキット化するなど、ユーザーの便宜を図る開発も求められます。
既存の半導体レーザーやCCDが使えるというアドバンテージがあるため、個人的な目算としては2010年ごろの実用化をめざしています。さらに「近赤外光で励起して可視発光を観察する」UPC蛍光バイオイメージングから、「近赤外光で励起して近赤外光を観察する」NIR蛍光バイオイメージングへと、研究開発を継続していく予定です。また、将来的には光と薬剤を使った治療法である近赤外励起フォトダイナミックセラピーへの応用もにらんでいます。現在は、複数の大手光学機器メーカーや、半導体量子ドット関連企業から連携の打診を受けています。
すべての画像