CRO事業の拡大に向けたArkMS株式会社による株式会社リメディアの事業譲受について
当社の子会社であるArkMS株式会社(アークメディカルソリューションズ、本社:東京都豊島区、代表取締役社長:水尾斉、以下「ArkMS」)は、CRO※1事業を行う株式会社リメディア(本社:東京都千代田区、代表取締役社長:小柴達夫、以下「リメディア」)との間で、リメディアの労働者派遣事業および委受託事業※2に関する事業譲渡契約を締結いたしましたので、下記のとおりお知らせいたします。
記
1.背景と目的
アルフレッサグループは、2032年度までの成長戦略「アルフレッサグループ中長期ビジョン」※3および「25–27 中期経営計画 Vision2032 Stage2 ~総合力で未来を切り拓く~」※4において、医薬品等の導入・開発、製造から物流・販売、市販後調査・ラストワンマイルまでをグループ一体となって提供するトータルサプライチェーンサービス(以下「TSCS※5」)を事業戦略の柱に位置付けております。
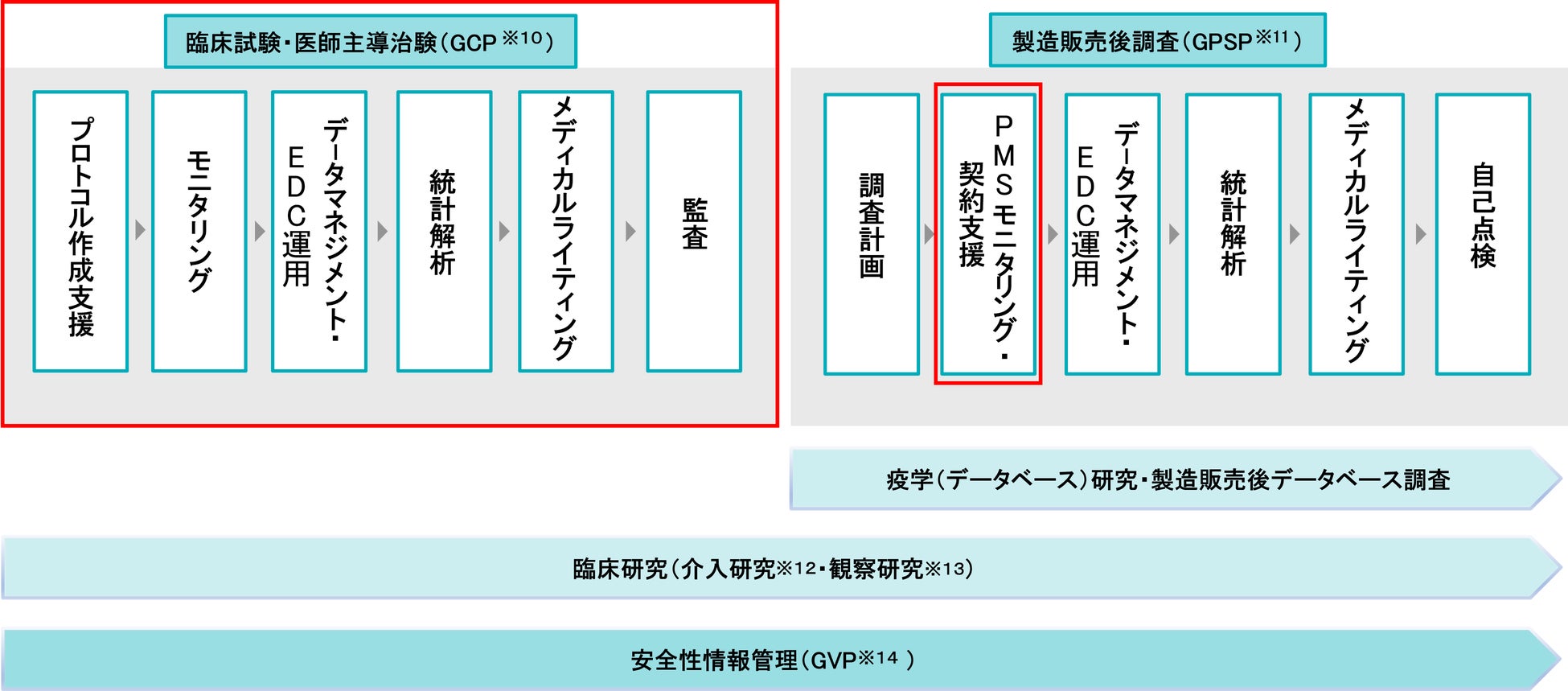
ArkMSはTSCSにおいて、CROとして医薬品等の開発支援を担っています。30年以上の実績で得た知見をもとに、医薬品・医療機器・再生医療等の分野で、臨床試験・医師主導治験の領域においては、プロトコル※6作成支援から、モニタリング、データマネジメント・EDC※7運用、統計解析、メディカルライティング※8、監査に至るまで、そして製造販売後調査の領域においては、調査計画から、PMS※9モニタリング・契約支援、データマネジメント・EDC運用、統計解析、メディカルライティング、自己点検に至るまで、包括的に高品質なソリューションを展開しています。
一方、リメディアは2014年の設立から10年以上にわたりCRO事業を展開しています。スペシャリスト人財の派遣や医薬品開発支援を通じて、アンメット・メディカル・ニーズを含む、がん・血液疾患・免疫疾患・中枢神経疾患など幅広い領域の臨床試験および臨床研究に対応し、製薬企業等の新薬開発の効率化に貢献しています。
このたびの契約締結により、ArkMSはリメディアが長年にわたり築いてきた事業基盤と高い専門性を有する人財を融合し、より強固なCRO事業体制を構築することで、両社の強みを最大限に活かし、本事業を拡大してまいります。
※1 CRO:(Contract Research Organization)製薬企業や研究機関が行う臨床試験に関する一連の業務を支援する専門機
関
※2 委受託事業:CROの領域における委受託事業とは、製薬企業などのスポンサーが臨床試験や製造販売後調査など
の開発関連業務の全部または一部をCROに委託し、CROがそれら業務を受託して実施する事業形態を指しています。
※3 ご参考:2023年5月15日発表
「アルフレッサグループ中長期ビジョン」策定のお知らせ
https://ssl4.eir-parts.net/doc/2784/tdnet/2281689/00.pdf
※4 ご参考:2025年5月15日発表
「25–27 中期経営計画 Vision2032 Stage2 ~総合力で未来を切り拓く~」策定のお知らせ
https://ssl4.eir-parts.net/doc/2784/ir_material21/256657/00.pdf
※5 TSCS:アルフレッサグループ全体で保有する様々な機能を有機的に一体活用することで、シームレスなサプライチェー
ンを確立し、医薬品等の導入・開発、製造から、物流・販売、市販後調査・ラストワンマイルまでをグループ一体となっ
て提供することを指しています。
※6 プロトコル:治験や臨床試験の目的、デザイン、評価項目、統計解析などの実施計画を詳細に規定した公式文書
※7 EDC:(Electronic Data Capture)症例報告書を紙ではなく電子的に収集・管理するためのシステム
※8 メディカルライティング:治験総括報告書や医薬品の承認申請資料、学会発表資料など、医学・薬学的な専門文書を
科学的妥当性と整合性を担保して作成する業務
※9 PMS:(Post Marketing Surveillance)医薬品や医療機器が販売された後に行われる品質、有効性および安全性の確
保を図るための調査
【本件で強化されるArkMSの機能】
(注)赤枠が強化される領域
※10 GCP:(Good Clinical Practice)医薬品の臨床試験を倫理的かつ科学的に実施し、データの信頼性を確保するための
国際的な基準・規制
※11 GPSP:(Good Post-marketing Study Practice)市販後の医薬品安全性を確認するため、使用成績調査やデータベー
ス調査等の実施方法・手順を定めた日本独自の省令
※12 介入研究:疾病と因果関係があると考えられる要因について、対象者に対して研究者が新しい治療などの介入を行
い、従来の治療などと比較してその有効性を検証する研究のこと
※13 観察研究:研究者が介入をせず、対象者の健康・疾病に関するデータを収集・分析して新しい知見を得る研究のこと
※14 GVP:(Good Vigilance Practice)市販後の医薬品・医療機器等の安全管理情報を収集・検討し、安全確保措置を実
施するための省令
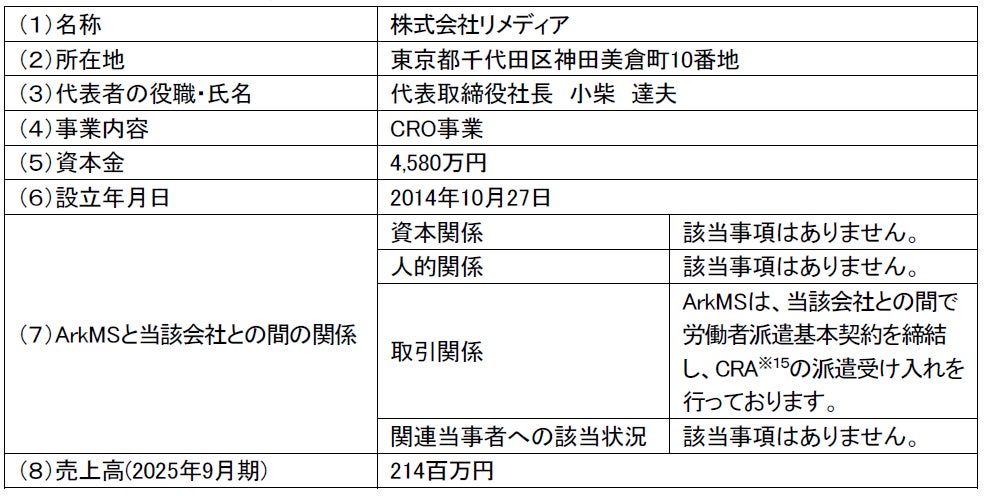
2.相手先(リメディア)の概要(2025年9月30日現在)
※15 CRA:(Clinical Research Associate)新薬の治験をGCP基準で監視し、データの信頼性を確保する専門職
3.日程
(1)事業譲渡契約締結日:2026年1月15日
(2)事業譲渡実行日:2026年3月31日(予定)
4.今後の見通し
本件による今期(2026年3月期)業績へ与える影響は、軽微であると見込んでおりますが、中長期的には当社グループの企業価値向上に資するものと考えております。
今後、本件に関して開示すべき事項が生じた場合には速やかにお知らせいたします。
以上
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
