RNAワールド仮説の中核をなすリボザイムの生成を実験的に検証 ~ATPとアミノ酸によって活性を制御できるアロステリックリボザイムを開発~
【研究の要旨とポイント】
近年、生命は自己複製できるRNAから生まれたとする「RNAワールド仮説」が有望視されていますが、触媒機能を持ったリボザイム(RNA酵素)の生成については、実験的な検証が十分には進んでいません。
今回、生命活動の中心的な役割を担うアデノシン三リン酸(ATP)やアミノ酸の一つであるL-ヒスチジン(His)に結合するRNAを人工的なRNA連結リボザイム(R3Cリガーゼ)に融合させることで、ATPやHisをそれぞれ感知し、連結活性を制御できる「アロステリックリボザイム」の開発に成功しました。
本研究は生命の起源の謎の解明に重要な光を投げかけるだけでなく、任意のRNAナノ構造体開発の礎となることが期待されます。
【研究の概要】
地球上の原始生命はRNAから進化したとされる「RNAワールド仮説」という考えがあります。「RNAワールド」が進化する過程では、短いRNAが重合することで、触媒としてはたらくリボザイム(RNA酵素)が生成したと考えられており、その進化過程に関しても実験的検証が求められています。なかでも、現在の地球上の生命現象において重要な役割を果たしているアデノシン三リン酸(ATP)やアミノ酸とRNAとの相互作用は、「RNAワールド」の進化における重要なステップとなる可能性があります。
東京理科大学先進工学部生命システム工学科の田村浩二教授らは、ATPとL-ヒスチジン(His:アミノ酸の一つ)に結合するRNAを人工的なRNA連結リボザイム(R3Cリガーゼ)に融合させることで、ATPやHisをそれぞれ感知し、連結活性を制御できる「アロステリックリボザイム」を開発することに成功しました。アロステリック効果とは、活性部位以外の部位になんらかのエフェクター分子が作用することで、元の分子の構造が変化し、活性(機能)が調節されるという現象です。本研究は、生命誕生の初期の段階におけるRNAの伸長過程で起こった可能性があるイベントについて、実験事実をもとに検証した極めて重要な成果といえます。
今回得られた新たな知見は生命の起源の謎の解明に重要な光を投げかけるだけでなく、外来分子の種類に依存しない一般的なアロステリックリボザイムやRNAナノ構造体の開発への道筋を拓くと期待されます。
本研究成果は、2024年4月17日に国際学術誌「Life」にオンライン掲載されました。
※PR TIMESのシステムでは上付き・下付き文字や特殊文字等を使用できないため、正式な表記と異なる場合がございますのでご留意ください。正式な表記は、東京理科大学WEBページ(https://www.tus.ac.jp/today/archive/20240416_6229.html)をご参照ください。
【研究の背景】
地球上の生命現象は、基本的に、DNA→RNA→タンパク質という遺伝情報の一方向の流れを提唱するフランシス・クリックの「セントラルドグマ」の概念に基づいています。しかし、DNAの生成にはタンパク質が必要であり、タンパク質はDNA の情報をもとに作られます。原始地球において、現生生物にみられる DNA、RNA、タンパク質などからなる複雑で洗練されたシステムが突然出現したとは考えにくく、生命の起源に関しては、「セントラルドグマ」がそのまま当てはまるのかについては議論があります。
その議論の中心をなすトピックが、核酸とタンパク質はどちらが先にできたのかという、分子版「鶏と卵」問題です。これに関しては、触媒活性を持つRNA(リボザイム)の発見を契機に、RNAが「遺伝情報の保存」と「触媒」の両方の機能を持ち、原始の生命活動はRNAのみによって行われていたという「RNAワールド」という考え方が提唱されてきました。
田村教授らは、2022年に、タンパク質合成の場であるリボソーム上のペプチジルトランスフェラーゼセンター(Peptidyl Transferase Center、PTC)が、対称的に配置された小RNAから構成され、これらを足場として、tRNAに付加されたアミノ酸がつながり、ペプチド結合を生成できることを証明しました(※1、※2)。これはタンパク質合成系の進化の歴史をひもとく重要な知見ですが、「RNAワールド仮説」に基づく進化の道筋を辿る上では十分ではなく、こうしたRNA自身を連結し、かつ、新しい機能的なRNAを生み出すプロセスを証明することが求められます。
※1 タンパク質合成場であるリボソームの起源と進化 ~原始tRNAと原始リボソームからのペプチドの生成~
https://www.tus.ac.jp/today/archive/20220420_8052.html
※2 田村 浩二教授らの研究が『Nature』誌の「NEWS FEATURE」に掲載
https://www.tus.ac.jp/today/archive/20230301_4829.html
そうしたプロセスの鍵を握る現象と考えられているのが、活性化部位以外の部位に特定の化合物(エフェクター)が作用することで、分子の構造が変化し、活性(機能)が調節されるアロステリック効果です。その代表例が、血液中の赤血球に含まれるヘモグロビンが示すアロステリック効果で、ヘモグロビンの四つのサブユニットの一つに酸素が結合することで、他のサブユニットに構造変化が誘発され、酸素と結合しやすくなります。これと同様に、RNAワールドの進化の過程で、RNAが伸長するプロセスにおいても、短いRNA がエフェクターと相互作用する別のRNAと融合し、その活性がエフェクター分子に依存して制御される、新しいRNA が生じた可能性があります(図1)。
本研究では、RNA を連結するリボザイムであるR3Cリガーゼを利用して、エフェクター分子の種類に依存しない一般的なアロステリックリボザイムの開発を目指しました。
【研究結果の詳細】
RNAワールド仮説を検証するため、既存のR3Cリガーゼリボザイム(73ヌクレオチド)の縮小化が行われ、46ヌクレオチドからなるR3C-Aが作製されました。作製されたR3C-Aの連結活性は元のR3Cリガーゼリボザイムと比べ、著しく低下しました。
R3Cリガーゼリボザイムは、Grip、Hammerと呼ぶ領域を含む三又構造を持ち、自身にRNA分子を連結するリボザイムです(図2)。R3C-AのHammer部分にアデノシン三リン酸(ATP)結合アプタマーRNA(アプタマー:特定の分子に対して結合能を示す一本鎖核酸)を融合させたR3C-ATP3を作製し、連結反応を行ったところ、ATPの濃度上昇に伴い、その活性が上昇しました。また、R3C-ATP3はATP特異的な活性を示し、ATP以外のヌクレオチド三リン酸(CTP、GTP、UTP)への依存性は見られませんでした。さらに、ATP結合アプタマーのループ構造を除去したR3C-ATP3-deloopとHammer部分を短くしたR3C-ATP3-GAAAを作製したところ、両方ともATP濃度によらずに高い連結活性を示しました(図2)。
融解温度(Tm値)はRNAの安定性を示す一つの指標となりますが、R3C-ATP3は、ATPが存在時にTm値が高くなりました。ATP存在下ではR3C-ATP3のステム構造が堅くなる(安定化する)と考えられ、こうした構造の堅さがリガーゼ活性の変化に影響を与えることが示唆されました(図3)。
ATP以外のエフェクター分子にも対応できるようにすることを目指して、R3C-AのHammer部分にL-ヒスチジン(His)結合アプタマーRNAを融合させたR3C-Hisを作製しました。その結果、His濃度の上昇に伴い、連結活性が上昇しました。L-ヒスチジンの他に、L-アルギニン、L-グルタミン酸、L-アスパラギン酸、グリシン、L-バリン、L-セリン、L-フェニルアラニンの計8種のアミノ酸を加え、連結反応を行いました。しかし活性の上昇は、Hisの場合のみ観察されました。また、Hisの側鎖部分に相当するイミダゾールが連結反応に与える影響を調べるために、イミダゾールの存在下で反応を行いましたが、活性に変化はありませんでした。したがって、R3C-Hisにおいては、イミダゾール部分ではなく、Hisのアミノ酸構造全体が活性に関与している可能性があります(図4)。
【今後の展望】
本研究では、R3Cリガーゼを基盤として、異なるエフェクター化合物(ATPとHis)と相互作用するための特異的ドメインを付加することで、アロステリックリボザイムを作り出すことに成功しました。これは、RNAワールドが、RNAの伸長過程にどのようなイベントを経て、進化したのかについて、実験事実をもとに検証した極めて重要な成果です。
ATPは生細胞内の多くのプロセスを駆動し、サポートするためのエネルギーを供給しており、一方、Hisはリボース5-リン酸とATPから生合成されています。さらに、Hisは多くの酵素の酸塩基化学において重要な役割を担っており、酵素の活性部位に存在する最も一般的なアミノ酸でもあります。
本研究は、RNA進化における「アロステリシティーを基盤とした機能や協同性の獲得」の過程の解明につながります。本研究で得られたRNA-RNA相互作用、RNA-アミノ酸相互作用、および、アロステリシティーをRNAに付加したり、これらのRNAを順次つなげたりすることにより、任意のRNAナノ構造体の作製の可能性も考えられます。特に産業応用につながるリボザイムやRNA研究の進展と相まって、今後、こうした研究の発展も大いに期待されます。
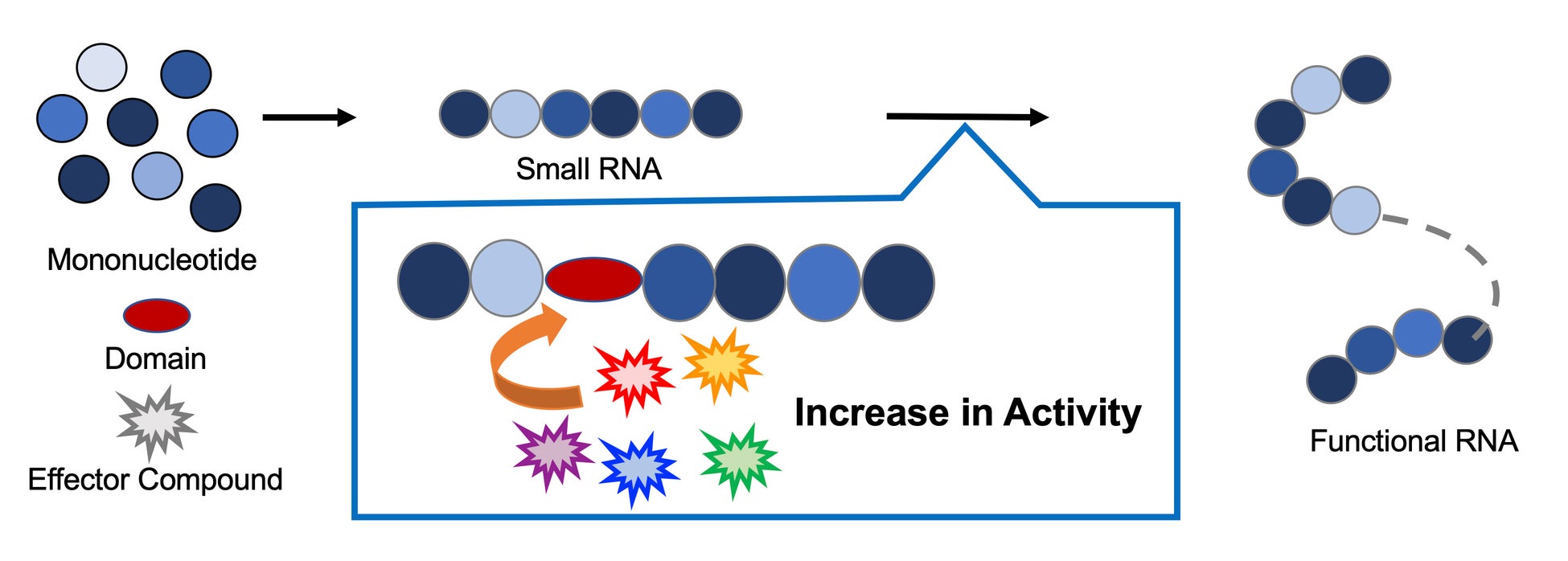
図1 リボザイムの進化過程の模式図。RNAが伸長する過程で、短いRNAは特定の化合物(エフェクター)と相互作用する他のRNAドメインと融合し、その結果、活性制御が特定のエフェクターに依存するRNAができたと考えられる。
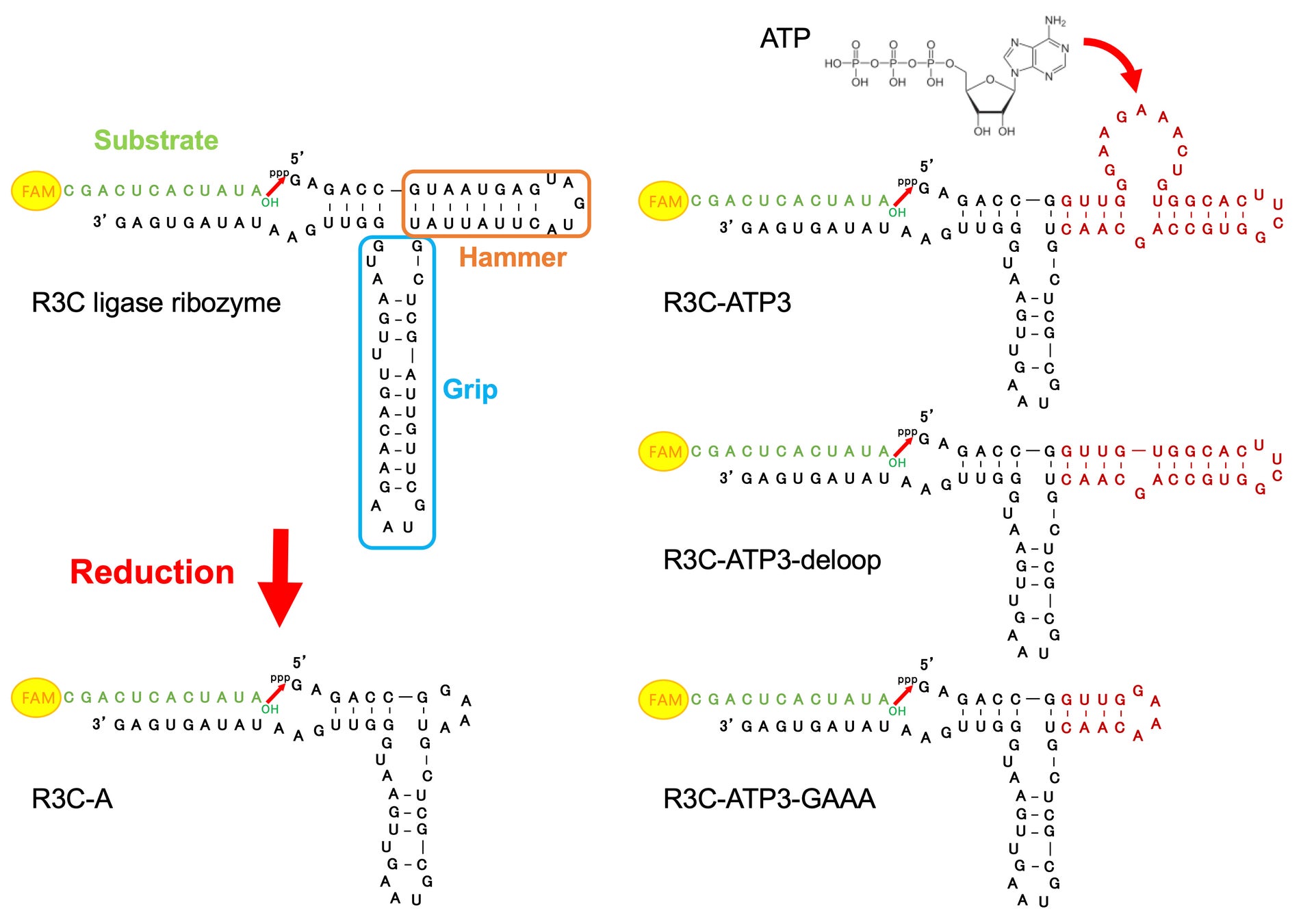
図2 (左)R3Cリガーゼリボザイム(73ヌクレオチド)、および、その縮小化リボザイムであるR3C-A(46ヌクレオチド)。R3Cリガーゼリボザイムは、Grip、Hammerと呼ぶ領域を含む三又構造を持ち、自身にRNA基質(緑色の分子)を連結するリボザイムである。(右)R3C-AのHammer部分にATP結合アプタマーRNAを融合させたR3C-ATP3は、ATP依存的に連結活性を示し、ATP結合アプタマーのループ構造を除去したR3C-ATP3-deloopとHammer部分を短くしたR3C-ATP3-GAAAは、両方ともATP濃度によらずに高い連結活性を示した。
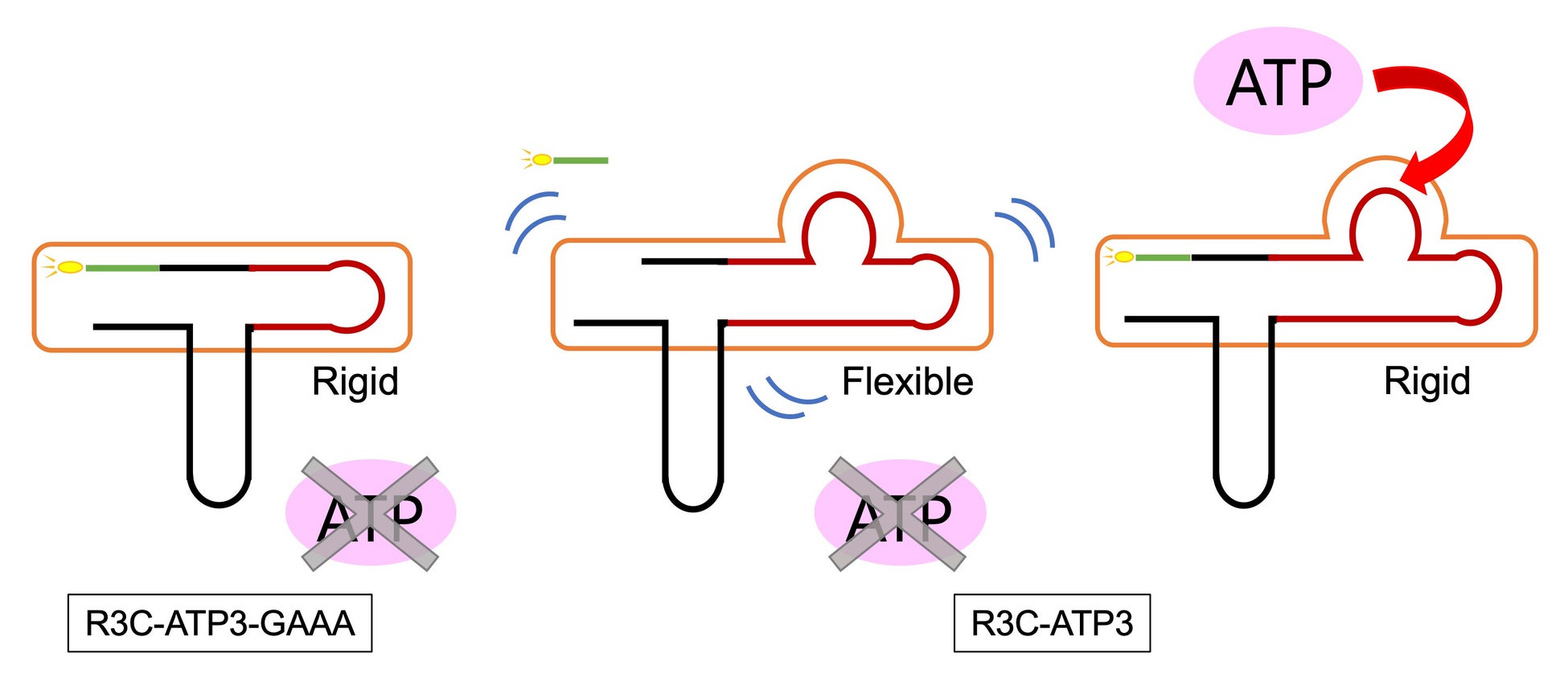
図3 R3C-ATP3-GAAAとR3C-ATP3の安定性の模式図。R3C-ATP3-GAAAの場合、連結部位周辺のステム構造は、ATPの有無に関係なく堅いと考えられる(Rigid)。対照的に、R3C-ATP3はATP非存在下では柔軟なコンフォメーションをとり(Flexible)、ATP存在下では安定になる(Rigid)。
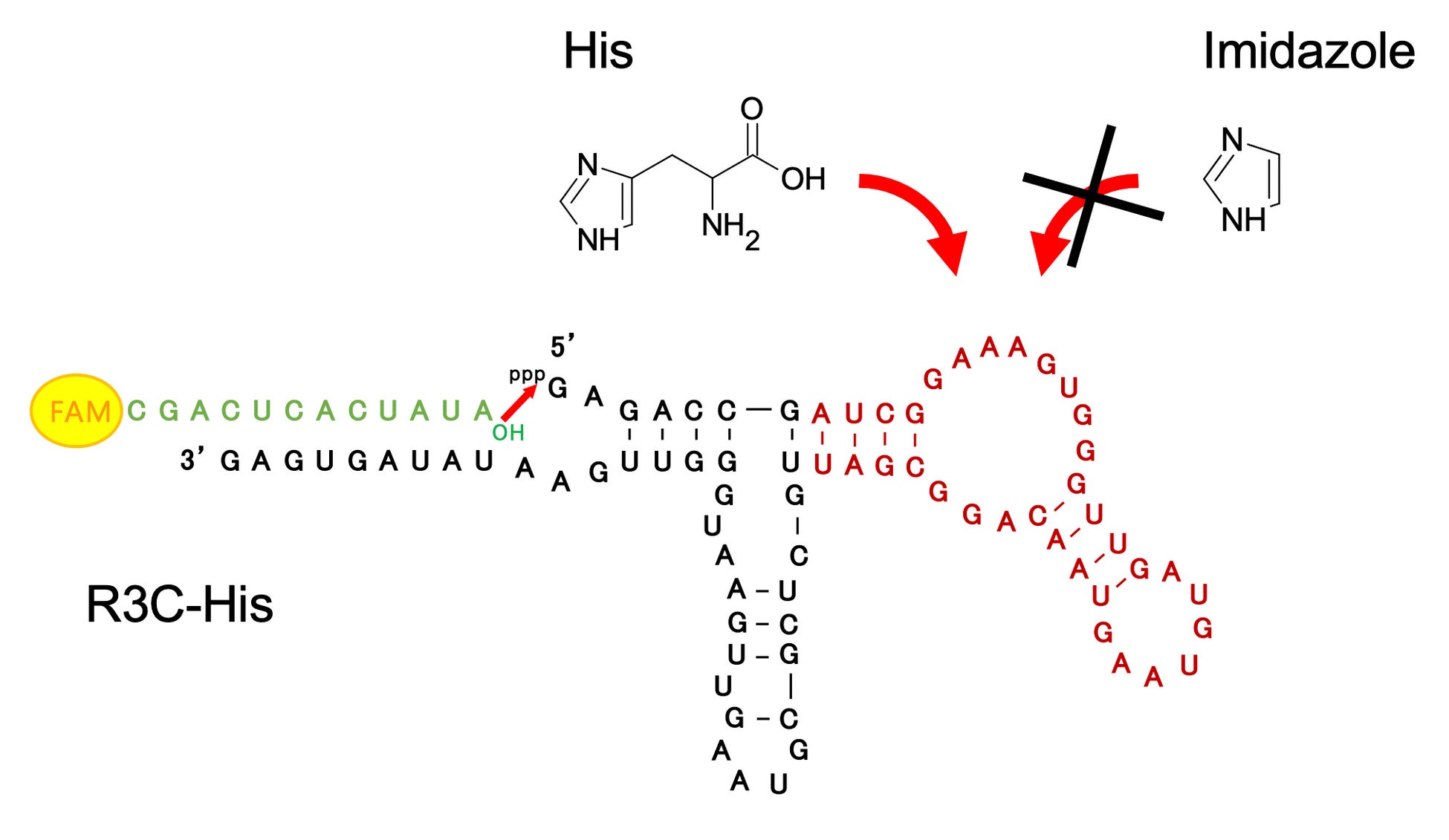
図4 R3C-AのHammer部分にHis結合アプタマーRNAを融合させたR3C-His。R3C-HisはHis依存的に連結活性を示したが、Hisの側鎖部分に相当するイミダゾールでは、活性の上昇が見られなかった。
※本研究は、日本学術振興会科学研究費補助金(21K06293、19K16204)の助成を受けて実施したものです。
【論文情報】
雑誌名:Life
論文タイトル:Development of Allosteric Ribozymes for ATP and L-Histidine Based on the R3C Ligase Ribozyme
著者:Yuna Akatsu, Hiromi Mutsuro-Aoki and Koji Tamura
DOI:10.3390/life14040520
URL:https://doi.org/10.3390/life14040520
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
