抗ヒスタミン薬Doxepinの異性体による結合特性のちがいを解明 ~次世代抗ヒスタミン剤の設計へ向けた新たな知見~
【研究の要旨とポイント】
抗うつ薬や不眠症治療薬として用いられるDoxepinに含まれる 2 種類の幾何異性体(E体,Z体)のうち、Z体のほうがヒスタミンH1受容体(H1R)に対して約5倍強く結合することを明らかにしました。
分子動力学シミュレーションから、H1R のリガンド結合ポケットにある Thr112 が、Z 体に対する選択性を高めるための化学的な環境をつくり出していることが示されました。
より効果と安全性が高い次世代の抗ヒスタミン薬を設計する新たな指針となることが期待されます。
【研究の概要】
東京理科大学 先進工学部生命システム工学科の白石 充典教授、同大学 先進工学部電子システム工学科の安藤 格士准教授、ならびに同大学大学院 先進工学研究科生命システム工学専攻の金子 大斗氏(修士課程2年)らの研究グループは、G蛋白質共役型受容体(GPCR) の一つであるヒスタミンH1受容体(H1R)に高い親和性で結合する三環系抗うつ薬Doxepinについて、異性体によるH1Rとの結合親和性のちがいについて調査しました。
Doxepinは幾何異性体(*1)によって効果にちがいがあることが確認されていますが、各異性体と H1R との親和性については報告されていません。そこで、本研究では、実験とシミュレーションの両面からDoxepinと H1R の親和性について調査しました。
その結果、Doxepin のZ 体の方が H1R に対して約5倍強く結合すること、H1R のリガンド結合ポケットにある Thr112 が Z 体に対する選択性を高めるための化学的な環境をつくり出していることが示されました。
本研究成果は、2024年6月25日に国際学術誌「Journal of Molecular Recognition」にオンライン掲載されました。
※PR TIMESのシステムでは上付き・下付き文字や特殊文字等を使用できないため、正式な表記と異なる場合がございますのでご留意ください。正式な表記は、東京理科大学WEBページ(https://www.tus.ac.jp/today/archive/20240701_7128.html)をご参照ください。
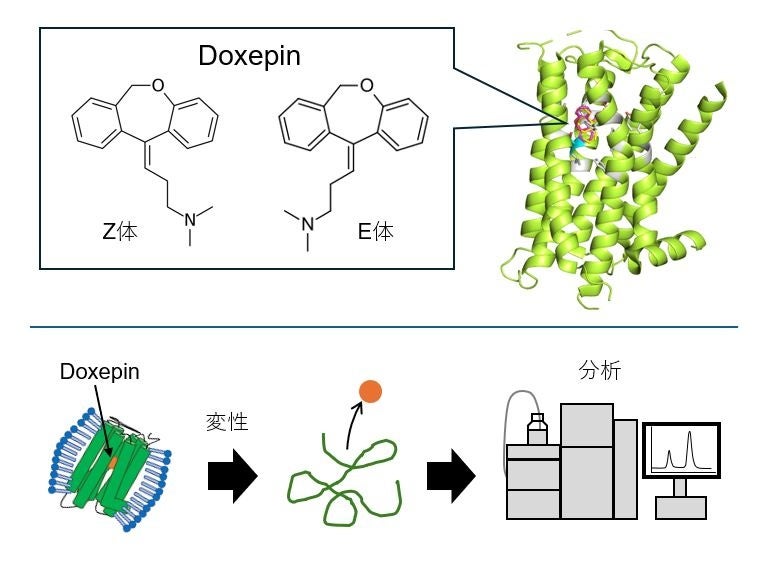
図. 本研究の概要。DoxepinとH1Rの複合体から、H1Rに結合したDoxepin異性体を解析した。
【研究の背景】
同じ分子式を持ちながら、立体的に異なる構造を持つ化合物のことを異性体と呼び、一般的に、異性体によって薬理活性は異なります。2つの異性体の薬理活性が類似しており、毒性の懸念もない場合は、異性体混合物として使用されますが、もし一方の異性体がより高い生物学的活性を持つ場合、光学異性体と受容体との間の構造的な相互作用を解明することで、より効果的な化合物の設計が可能になります。
Doxepinには、E体、Z体という2種の幾何異性体が存在していますが、両者を選別せず、異性体混合物として使用されています。Doxepinは三環系抗うつ薬として開発され、抑うつ障害、不安障害、不眠症などの治療に主に適応されますが、強力なヒスタミン H1受容体(H1R)拮抗薬であり、掻痒症(発疹の出ないかゆみ)の治療のための抗ヒスタミン薬としても使用されています。Doxepinを始めとする第二世代抗ヒスタミン薬(*2)は、副作用が生じにくく、抗アレルギー薬の主流となっています。しかし、患者によっては十分な効果が得られないことや、副作用が生じるケースもあり、より優れた抗ヒスタミン薬の開発が求められています。
白石教授らはこれまでに、H1RとDoxepinの複合体の結晶構造を明らかにしています(Shimamura and Shiroishi et al., Nature, 2011)。この研究から、Doxepinは受容体のオルソステリックサイトに結合していることがわかっています。具体的には、Doxepinの3級アミノ基は、アミン作動性受容体で保存されている第3膜貫通ヘリックス領域のD1073.32(上付き文字はGPCRのアミノ酸残基の位置を指定するBallesteros-Weinstein番号)と塩橋を形成しています。一方、三環部分はH1Rの疎水性アミノ酸側鎖(Y108 3.33, I115 3.40 ,W158 4.56, F424 6.44, W428 6.48, F432 6.52, F435 6.55)と疎水性相互作用を形成していることがわかりました。しかし、E体とZ体のどちらが優占的に結合しているかはわかっていませんでした。
DoxepinはE体とZ体のモル比85:15の混合物として製剤化されていますが、動物モデルを用いた薬理試験では、Z体がE体よりも抗ヒスタミン薬として効果的であることが示されています。しかしながらそれぞれの異性体の H1R に対する親和性についてはまだ明らかになっていませんでした。
そこで、本研究ではDoxepinのそれぞれの異性体について、実験・シミュレーションの両面から H1R に対する親和性を評価しました。
【研究結果の詳細】
・HPLC によるH1R とDoxepin異性体の結合分析
始めに、H1Rに結合するDoxepin異性体の比率を HPLC(*3)によって分析しました。出芽酵母で発現させたH1Rタンパク質を、Doxepinを含むバッファで精製しました。余分なDoxepinを除去した後、H1R-Doxepin複合体を回収しました。ここで、アセトニトリルによって H1R のタンパク質構造を変性させることで複合体中のDoxepinを放出させて分析しました。Doxepin異性体のH1Rに対する解離定数(Kd)の比率をピーク面積比から推定したところ、Z体はE体より約5.2倍高い親和性を持つことが分かりました。
・H1R 変異体を用いたDoxepin異性体の結合分析
白石教授らのこれまでの結晶構造解析研究から、Doxepin E体の酸素原子とH1Rのリガンド結合ポケットにあるThr112のT112 3.37側鎖のヒドロキシ基との間には強くはないものの水素結合が形成される可能性が示唆されています。一方、Z体の酸素原子とT112 3.37側鎖のヒドロキシ基との間は4.3 Å離れており、水素結合を形成することはできません。しかしながら、薬理学実験や上述のHPLC の実験においては、Z 体がより高い親和性でH1R と結合することが示されています。
そこで、本研究ではT112 3.37の側鎖にあるヒドロキシ基に着目し、T112 3.37を水素結合を形成しないバリンに変更した H1R 変異体(T112 3.37 V)を用いて、Doxepinの結合分析を行ないました。その結果、 この変異体においてはE 体の方が Z 体よりも 1.4 倍高い親和性をもつことが分かりました。これは、T112 3.37 V変異体では、野生型H1RにおけるE体とZ体の5.2倍の差で見られたような有意な親和性の差は認められなかったことを意味します。
・分子動力学(MD)シミュレーション(*4)による結合様式の解析
なぜDoxepinの異性体がH1Rに対して親和性のちがいを示すのかを検討するために、分子動力学シミュレーションを用いた熱力学的積分法(*5)(TI-MD)により、野生型H1RおよびT112 3.37 V変異体におけるDoxepin異性体間の結合自由エネルギー差を計算しました。
TI-MDシミュレーションから得られたH1R およびT112 3.37 V 変異体におけるDoxepin異性体間の結合自由エネルギー差は、それぞれ0.63 ± 0.37 kcal/mol、−0.42 ± 0.41 kcal/molと(値が正に大きいほどZ体の方が高い親和性を示すことを意味する)、HPLC分析によって得られた実験による相対的な結合自由エネルギー差と概ね一致していました。
そこで、野生型H1RとDoxepinの複合体におけるT112 3.37のヒドロキシ基とDoxepin酸素原子間の水素結合についてもTI-MDシミュレーションで調べたところ、Doxepin E体の酸素原子はヒドロキシ基と水素結合を形成できるほど近い位置にあるものの、水素結合に適した角度を形成するのは難しいことがわかりました。また、T112 3.37のヒドロキシ基はDoxepinと水素結合を形成する代わりに、Y108 3.33骨格のカルボニル酸素と安定に水素結合を形成することが示されました。さらに、T112 3.37のヒドロキシ基は、野生型H1RのW158 4.56とN198 5.46の側鎖とも水素結合を形成している可能性があることもわかりました。野生型H1RはE体よりもZ体に安定に結合できることを踏まえると、T112 3.37が結合部位でZ体がより結合しやすい化学的環境を構築していると考えられます。
白石教授は本研究について、「私たちは以前H1RとDoxepinの複合体の結晶構造を明らかにしましたが、どちらの異性体が結合しているのかはわかっていませんでした。本研究で得られた知見は、より高い効果と安全性を有する次世代の抗ヒスタミン薬を設計するための基礎となりうるものです」とコメントしています。
※本研究は、日本学術振興会の科研費(JP25709080, JP15K14460)、国立研究開発法人日本医療研究開発機構 創薬等ライフサイエンス研究支援基盤事業(創薬等支援技術基盤プラットフォーム事業)の助成を受けて実施したものです。
【用語】
*1 幾何異性体
炭素間の二重結合によって生じる立体異性体。シス-トランス異性体ともいう。
*2 第二世代抗ヒスタミン薬
第一世代抗ヒスタミン薬は 1940 年代に開発され、アレルギーの治療薬として使用されてきた。しかし、第一世代抗ヒスタミン薬は血液脳関門を容易に通過するために眠気を引き起こしたり、抗コリン作用による口渇を引き起こしたりする副作用がある。1980 年代以降、第二世代抗ヒスタミン薬が開発された。これらの薬は血液脳関門を通過しにくく、受容体選択性が向上しているため、現在の主要な抗アレルギー薬となっている。
*3 HPLC(高速液体クロマトグラフィー)
カラムクロマトグラフィー(試料を溶かした溶液を移動相によってカラムを通過させる。カラムとの相互作用により生じる通過速度の差を利用して試料を分離する)の一種であり、移動相として高圧に加圧した液相を用いる。
*4 分子動力学(MD)シミュレーション
ニュートンの運動方程式を用いて原子や分子の動きをシミュレーションする手法。
*5 熱力学的積分法
2 つの状態間の自由エネルギーの差を計算機シミュレーションにより算出する手法。
【論文情報】
雑誌名:Journal of Molecular Recognition
論文タイトル:Binding characteristics of the doxepin E/Z isomers to the histamine H1 receptor
revealed by receptor-bound ligand analysis and molecular dynamics study
著者:Hiroto Kaneko, Ryunosuke Korenaga, Ryota Nakamura, Shinnosuke Kawai, Tadashi Ando, Mitsunori Shiroishi
DOI:10.1002/jmr.3098
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
