電気化学小角X線散乱法により、酸化還元酵素の酸化体・還元体の構造を解明 ~生物学的試料における初の試み~
【研究の要旨とポイント】
酸化還元酵素において、酸化体、還元体の詳細な構造を理解することは、より優れたバイオデバイスの開発に必要不可欠です。
本研究では、電気化学小角X線散乱法(EC-SAXS)を用いて、電気化学的に酸化還元させたビリルビンオキシダーゼ(BOD)の構造解明に成功しました。
本研究をさらに発展させることで、酵素電極、バイオセンサなどのバイオデバイスの性能向上に貢献することが期待されます。
【研究の概要】
東京理科大学 創域理工学部 先端化学科の四反田 功准教授、プロジェクト研究員のNoya Loew博士、同大学大学院 創域理工学研究科 先端化学専攻の澤原 千晶氏(2024年度 修士課程2年)、株式会社資生堂の小倉 卓氏(東京理科大学 客員准教授)、株式会社アントンパール・ジャパンの高崎 祐一氏らの共同研究グループは、電気化学小角X線散乱法(EC-SAXS)を用いて、電気化学的に酸化還元させたビリルビンオキシダーゼ(BOD)の構造解明に成功しました。
BODは、小型で単一ドメインの酸化還元酵素の1つで、中性条件下で高い活性を持つため、バイオ燃料電池の酸素還元電極などに応用されています。本研究グループは、生体内で重要な役割を果たすBODに関して、「酸化還元反応中に構造変化を起こすのか」、「酸化還元反応による構造変化を明らかにする方法はないか」といった課題を解決するための研究を進めてきました。そして今回、電気化学的手法と小角X線散乱を組み合わせたEC-SAXSをBODに適用するという発想から、酸化還元反応時のBODの構造変化について詳しく調べました。
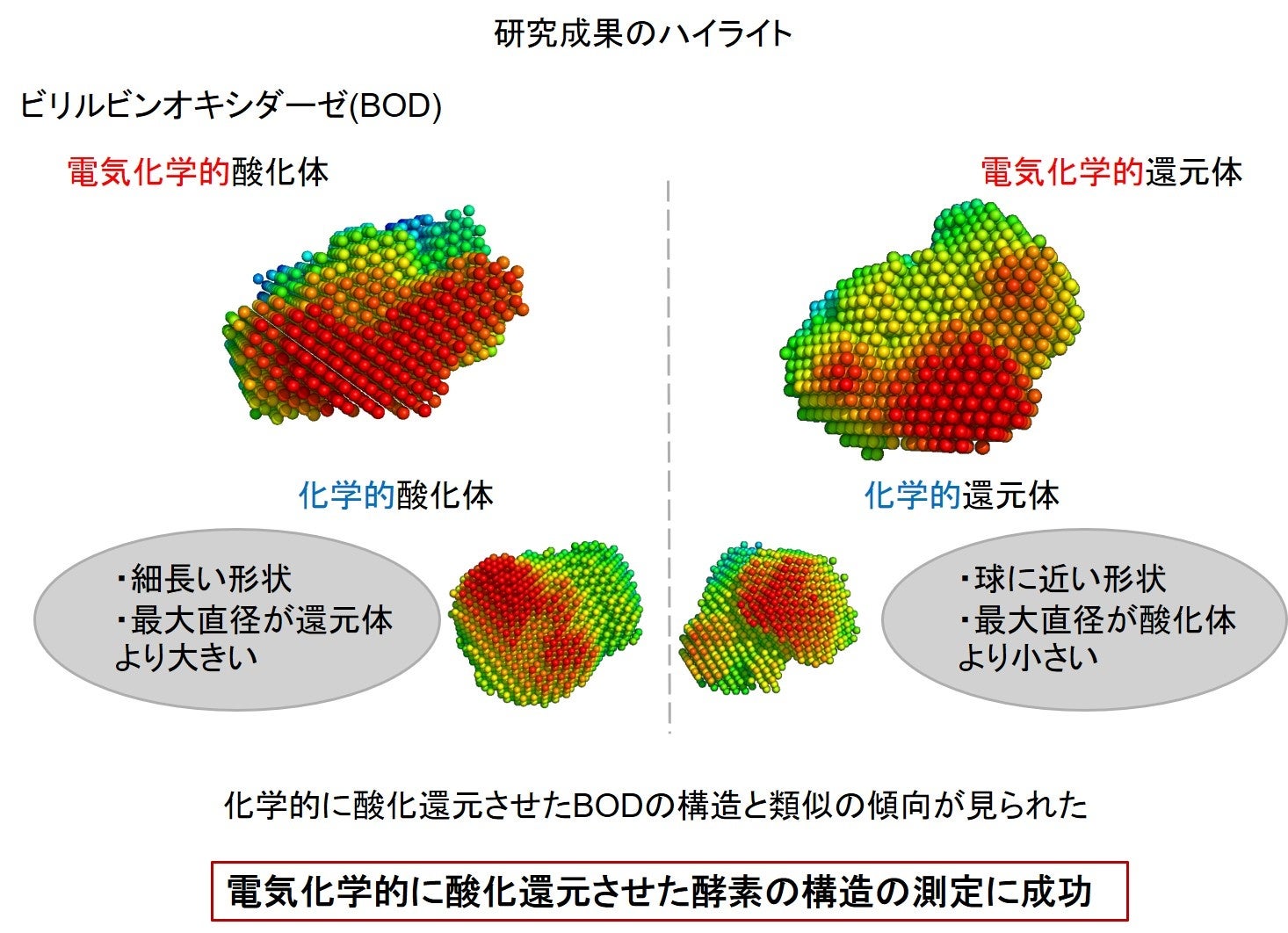
本研究では、EC-SAXSを用いて、BODの電気化学的酸化体と電気化学的還元体のX線散乱データを取得し、その構造解析を行いました。その結果、BODは酸化還元反応中、開いた構造(オープン型)と閉じた構造(クローズド型)を交互に変化させており、酸化体では主にオープン型、還元体では主にクローズド型が形成されることを明らかにしました。また、化学的に酸化還元させたBODの構造と類似の傾向が見られることも判明しました。さらに、一般的なSAXSでは、酸化体と還元体を分析する際に異なる添加剤が必要であるのに対し、EC-SAXSでは、同一の添加剤の存在下で酸化体と還元体の分析が可能であることが確認されました。
本研究成果から、EC-SAXSが酸化還元酵素の反応メカニズムを理解するための有望な手法であることが示唆されました。酵素の酸化還元反応メカニズムの理解が進むことで、酵素ベースのバイオデバイスの性能向上が期待されます。
本研究成果は、2024年12月31日に国際学術誌「Langmuir」にオンライン掲載されました。
【研究の背景】
酸化還元酵素は、酸化還元反応を触媒する酵素であり、生体内の化学反応において重要な役割を果たしています。これらの酵素は、酸化還元反応を効率的に進行させる能力を持つため、バイオエレクトロニクス分野への応用が期待されています。特に、酸化還元酵素を電極表面に固定した酵素電極は、酵素反応を介して電気信号を生成できるため、バイオセンサやバイオ燃料電池などのデバイスに利用されています。
ビリルビンオキシダーゼ(BOD)は、小型で単一ドメインの酸化還元酵素であり、バイオ燃料電池の酸素還元電極に利用されています。BODは4つの銅原子を有し、そのうち3つはT2/T3サイトと呼ばれる三核クラスターを形成し、酸素を結合して還元しています。しかしながら、BODの酸化還元反応においてどのような構造変化が起こるのかは未解明のままで、これを明らかにすることは、酸化還元酵素の反応メカニズムの全容を解明する上で非常に重要です。
従来、酵素の構造評価には主に単結晶X線構造解析が使用されてきました。しかしながら、この手法は結晶サンプルの質や状態に依存するため、すべての酵素に対して詳細な解析を行うことは困難で、現実的ではありません。また、酸化還元酵素や酸化還元タンパク質は、酸化還元反応中に構造変化を伴うことが多いため、その構造の詳細な解明が難しいという課題がありました。
以上の背景から、本研究グループはEC-SAXSをBODに適用するという着想を得て、BODの電気化学的酸化体と電気化学的還元体における構造的な違いを調査しました。
【研究結果の詳細】
EC-SAXSを用いて、BODの電気化学的酸化体 (−0.1V vs Ag/AgCl)と電気化学的還元体(0.8V vs Ag/AgCl)のX線散乱データを測定しました。いずれの散乱強度も、BOD濃度が減少するにつれて低下しましたが、同一濃度では、酸化体と還元体の間で明確な違いが見られました。平均最大直径(Dmax)は、酸化体では7.5 ± 0.4 nm、還元体では6.7 ± 0.2 nmでした。また、平均分子量は、酸化体では63 ± 9 kDa、還元体では58 ± 2 kDaで、文献値の66 kDaと比較して±15%以内でした。これらの結果から、BODの還元体が酸化体よりもコンパクトな形状を形成していることが示唆されました。さらに、化学的に酸化還元したBODの構造は、電気化学に酸化還元したBODにおける傾向と類似していました。
BODの酸化体と還元体の高解像度モデルを得るために、既存のBODの結晶構造を基に、測定したSAXSデータを用いて解析を行いました。精密化には、SREFLEX とCRYSOL を使用しました。その結果、BODの酸化体は主に開いた構造(オープン型)、還元体は主に閉じた構造(クローズド型)を形成することが判明しました。この違いは、Asn-197(197番目のアスパラギン酸)とAsn-394(394番目のアスパラギン酸)の残基間の平均距離に反映されており、オープン型ではクローズド型よりも距離が長くなっていることがわかりました。電気化学的酸化体と電気化学的還元体の平均距離は、それぞれ2.8 ± 0.7 nmと1.7 ± 0.6 nmでした。一方、化学的酸化体と化学的還元体の平均距離は、それぞれ3.0 ± 0.9 nmと2.5 ± 1.0 nmでした。酸化体では、T1 Cuを含む銅イオンがCu2+として強い正の電荷を示すのに対し、還元体ではCu+は弱い電荷を示します。この違いにより、酸化体がオープン型を優先して形成するのは、正に帯電したアミノ酸残基間の反発や、負に帯電した分子との相互作用が関与している可能性が示唆されました。
本研究を主導した四反田准教授は、「本学の機器センターに日本で初めて、高性能の小角X線散乱装置が導入され、放射光施設のような条件で測定が可能になったことで、本研究を実現することができました。本研究成果は、スマートライフに欠かせないバイオセンサや酵素を使ったモノづくりにおいて、酵素の挙動を正確に把握することで、その効率や生産性の向上に貢献することが期待されます」と、コメントしています。
【論文情報】
雑誌名:Langmuir
論文タイトル:Electrochemical Small-Angle X-ray Scattering for Potential-Dependent Structural Analysis of Redox Enzymes
著者:Noya Loew, Chika Miura, Chiaki Sawahara, Saki Otobe, Taku Ogura, Yuichi Takasaki, Hikari Watanabe, Isao Shitanda, and Masayuki Itagaki
DOI:10.1021/acs.langmuir.4c03661
※PR TIMESのシステムでは上付き・下付き文字や特殊文字等を使用できないため、正式な表記と異なる場合がございますのでご留意ください。正式な表記は、東京理科大学WEBページ(https://www.tus.ac.jp/today/archive/20250123_3586.html)をご参照ください。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
