ポリアミンががん細胞の増殖を促進するメカニズムを解明 ~がん治療など医療への応用にも期待~
【研究の要旨とポイント】
ポリアミンの一種であるスペルミジンの長期摂取は、アンチエイジング作用を示すことが近年注目されています。
一方、ポリアミンは癌の悪性度にも関連することが知られていますが、がんの増殖におけるポリアミンの詳細な役割は明らかとなっていません。
本研究においてプロテオーム解析を行った結果、がん細胞においてポリアミンは翻訳開始因子eIF5A2の生合成を促進することが明らかとなりました。
がん細胞の増殖はeIF5A2に依存すること、およびポリアミンはeIF5A2が働きやすいようにリボソームを構成するタンパク質の組成を変化させることが明らかとなりました。
本研究により、がん特異的リボソームへのeIF5A2の結合部位 (リボソームE部位)が新たな分子標的として有望であり、副作用が少ない医薬品の開発が期待されます。
【研究の概要】
東京理科大学 薬学部 薬学科の東 恭平准教授、東京理科大学大学院 薬学研究科の鈴木 雅斗氏(2025年度博士課程修了)、理化学研究所 環境資源科学研究センターの鈴木 健裕氏らの研究グループは、細胞増殖促進因子ポリアミン(プトレッシン: PUT、スペルミジン: SPD、スペルミン: SPM)が、翻訳開始因子eIF5A2の生合成を促進すること、およびがん細胞の増殖はeIF5A2に依存しており、ポリアミンはeIF5A2が働きやすいようにリボソームの構成タンパク質の組成を変化させることを明らかにしました。本研究成果より、がん特異的リボソームへのeIF5A2の結合部位 (リボソームE部位)ががん選択的な分子標的として有望であることが示唆されました。
ポリアミンはウイルスからヒトまですべての生物に存在する塩基性生理活性物質であり、細胞増殖・分化に必須の因子です。生体内にはPUT、SPD、およびSPMの3種が存在し、その恒常性は人の健康と密接に関係しています。ポリアミンは塩基性物質であることから、酸性物質であるRNAなどとの相互作用を通じて多様な生物活性を示すことがわかっています。近年、SPDの長期投与はオートファジー遺伝子の発現を促進することでミトコンドリア機能を亢進し、老化した免疫細胞や卵母細胞の活性化、酵母、線虫、マウスの寿命延伸効果、およびショウジョウバエとマウスの脳機能改善効果を示すなど、多様なアンチエイジング作用が報告されています。
一方、ポリアミン生合成律速酵素オルニチン脱炭酸酵素 (ornithine decarboxylase: ODC)、S-アデノシルメチオニン脱炭酸酵素 (S-adenosylmethionine decarboxylase: SAMDC)、およびポリアミンががんの悪性度に関与することが1990年前半より報告されていますが、がんの増殖におけるポリアミンの詳細な役割はほとんど分かっていません。
これまでポリアミン生合成阻害剤の抗腫瘍活性が検討されてきましたが、これら阻害剤は選択性が低く、投薬を中止するとポリアミン輸送系が活性化して組織ポリアミン量が回復してしまう欠点がありました。本研究グループは、細胞内ポリアミン量を制御するよりも、ポリアミン特異的に発現制御を受け、且つがんの増殖、浸潤、および転移に重要な役割を果たす遺伝子が新たな治療標的になるのではないかと考えました。
本研究では、ヒト子宮頸がん由来のHeLa S3細胞株をポリアミン生合成阻害剤の有無で培養した時の遺伝子発現の変化をプロテオーム解析により調べました。その結果、ポリアミンは解糖系遺伝子群の他、がんの悪性度との関連性が報告されている翻訳開始因子eIF5A2やリボソームタンパク質 (RPS27A、RPL22L1、およびRPL36AL)の発現を亢進していました。いくつかの乳がん細胞株でeIF5A2をコードする遺伝子の発現を抑制した結果、細胞増殖が著しく抑制されました。一方、正常細胞の増殖に必要で且つeIF5A2と高いアミノ酸相同性を有するeIF5A1をコードする遺伝子の発現を抑制した場合は増殖抑制作用は弱いことが分かりました。更に、プロテオーム解析によりeIF5A1とeIF5A2が発現制御する遺伝子の種類は全く異なることが明らかとなりました。eIF5Aは翻訳伸長に関与しますが、プロテオーム解析の結果は、eIF5A1とeIF5A2が結合するリボソームの構造 (性質)がそれぞれ異なることを示唆しています。
細胞内のポリアミンのレベルは、生合成、分解、輸送といった複数のメカニズムによって厳密に調節されており、その恒常性破綻は加齢性疾患やがんなどの病態と深く関連しています。本研究は、eIF5A1とeIF5A2 が細胞増殖において異なる機能的役割を担っていること、がん細胞の増殖はeIF5A2に依存することを明らかにしました。本研究により、がん特異的リボソームへのeIF5A2の結合部位 (リボソームE部位)ががん選択的な分子標的として有望であることが示唆されました。
本研究成果は、2025年7月4日に国際学術誌「Journal of Biological Chemistry」にオンライン掲載されました。
【研究の背景】
ポリアミンは、複数のアミノ基を持つ低分子化合物であり、ほとんど全ての生物でmMオーダーで生合成され、細胞増殖・分化において重要な役割を果たしています。しかしながら、低分子でかつ単純な構造であるためにmRNAなどの核酸との相互作用が弱く、分子レベルでの詳細な働きやその作用については十分に解明されていません。ポリアミンの一種であるSPDは、ミトコンドリア機能の活性化を通じ、寿命の延長や記憶障害の予防などのアンチエイジング作用を示すことがわかっています。一方で、がん細胞の増殖や浸潤にも関与していると言われてきましたが、その詳細なメカニズムは不明でした。
ポリアミンの生理作用に対する理解を複雑にさせるのが翻訳開始因子eIF5Aです。eIF5AはSPDを基質としてハイプシン化という翻訳後修飾をうける唯一のタンパク質で、真核細胞ではeIF5A1とeIF5A2が保存されています。eIF5A1は全ての細胞に恒常的に発現し細胞増殖・分化に必須な役割を果たします。ポリアミンによる多彩な生理活性の一部は、ハイプシン化されたeIF5A1に依存しており、最近では、アンチエイジング作用の一部は翻訳開始因子eIF5A1が担っていることが報告されています。
一方、eIF5A2はeIF5A1とのアミノ酸相同性が84%と高いものの遺伝子欠損による表現型はほとんど観察されなかったこと、eIF5A1に比べて発現量が低くウェスタンブロット法で検出が難しいことからその機能は注目されてきませんでした。しかしながら、近年、悪性度の高い癌組織においてeIF5A2の過剰発現が数多く報告されています。
ODC不可逆的阻害剤 (-difluoromethylornithine: DFMO*1)などを用いて、ポリアミン生合成を阻害した時の抗腫瘍活性が検証されてきましたが、これら阻害剤は癌選択性が低く、投薬を中止するとポリアミン輸送系が活性化して細胞内ポリアミン量が回復してしまう欠点がありました。また、ポリアミン量が減少させて細胞増殖を阻害する分子メカニズムもほとんど分かっていませんでした。
このような背景から、本研究グループはポリアミン特異的に発現制御を受け、かつがんの増殖、浸潤、および転移に重要な役割を果たす遺伝子が同定されれば新たな治療標的になるのではないかと考えました。
【研究結果の詳細】
まず、ヒト子宮頸がん由来HeLa S3細胞を用いて、ポリアミンによって調節される遺伝子を網羅的に調べました。HeLa S3細胞をDFMO存在下で72時間培養したところ、細胞内のPUTとSPD量が低下し、3日目には細胞数が未処理細胞の約40%にまで減少しました。一方で、DFMO処理細胞に、SPDを外から添加すると細胞の増殖が回復しました。さらに、未処理細胞およびDFMO処理細胞間で約6700種類のタンパク質を同定し、遺伝子発現化(Fold-change)をボルケーノプロット(*2)で解析しました。その結果、300種類(全体の約5.3%)のタンパク質がDFMO処理細胞で変化していることがわかりました。この中でも特に、がん細胞のエネルギー産生経路である好気的解糖と増殖に関与するピルビン酸デヒドロゲナーゼキナーゼ1(PDK1)、ピルビン酸キナーゼ2(PKM2)、翻訳開始因子eIF5A2やがんの悪性化に関連するリボソームタンパク質 (RPS27A、RPL22L1、およびRPL36AL)などの発現量が上昇していました。また、eIF5A1に関してもeIF5A2ほど顕著ではないものの、発現の上昇が観察されました。これに対し、酸化的リン酸化(OXPHOS)、オートファジー、TCA回路に関連する遺伝子の発現変動はわずかでした。実際に、HeLa S3細胞におけるエネルギー代謝にポリアミンがどのように関わっているのかを明らかにするため、DFMO処理した細胞で酸素消費速度(OCR*3)および細胞外酸性化速度(ECAR*4)を測定しました。その結果、DFMO処理した細胞では未処理の細胞に比べてOCRおよびECARの低下がみられたものの、ECARの減少がより顕著であったことから、HeLa S3細胞においてポリアミンは酸化的リン酸化よりもむしろ好気的解糖系の遺伝子の発現を制御することがこの実験で裏付けられました。
ポリアミンが全RNAの発現レベルに与える影響を調べるために、未処理細胞とDFMO処理細胞を用いてトランスクリプトーム解析を実施しました。16567種類のRNAにおける遺伝子発現比をボルケーノプロットで解析したところ、発現レベルが変動したRNAはわずか492種類(全体の2.97%)でした。この結果から、ポリアミンはmRNAよりもタンパク質の発現を変動させていることが示唆されました。さらに、タンパク質とmRNAの遺伝子発現比の間に相関がなかったことから、ポリアミンは転写調節よりもむしろ翻訳段階で遺伝子発現を調節し、がん細胞の増殖を促進していることがわかりました。
ポリアミンがeIF5A1およびeIF5A2の発現レベルに影響を及ぼすことが明らかになったため、これら2つのeIF5AsがHeLa S3細胞の増殖に与える影響を検討しました。HeLa S3細胞のeIF5A1およびeIF5A2の発現をsiRNA(*5)により抑制 (ノックダウン:KD)したところ、eIF5A2のKDでは3日目、eIF5A1のKDでは5日目に増殖阻害が観察されました。次に乳がん由来細胞株MCF7、MDA-MB-231、およびMDA-MB468で検討した結果、eIF5A2の発現を抑制すると著しい増殖阻害が観察されましたが、eIF5A1抑制ではほとんど阻害されませんでした。以上の結果より、がん細胞の増殖はeIF5A1よりもeIF5A2に依存することがわかりました。
次に、eIF5A1とeIF5A2をKDした時に発現が変化する遺伝子をプロテオーム解析で網羅的に調べました。その結果、eIF5A2とeIF5A1のKDによって発現が阻害される遺伝子が全く異なっていることが明らかとなりました。eIF5Asは翻訳伸長に関与しますが、プロテオーム解析の結果は、eIF5A1とeIF5A2が結合するリボソームの構造 (性質)がそれぞれ異なることを示唆しています。近年、がんの増殖に適応したリボソームでは、RPL36Aなどのリボソームタンパク質の構成比が変化していることが報告されています。そこで、HeLa S3細胞をDFMO処理した時の遺伝子発現比を再度調べた結果、ポリアミンはRPS27A、RPL22L1、RPL29、RPL36AL、およびRPL36Aのリボソームタンパク質の発現を増加させることが分かりました。最近、リボソームE部位に結合するeIF5A1がクライオ電子顕微鏡で解かれ、eIF5A1はハイプシン残基がP部位 tRNAのCCA末端に、C末端側がリボソームE部位に位置するRPL10Aと相互作用することが報告されました。eIF5A1とeIF5A2のアミノ酸残基の違いはC末端側に集中していますので (図1)、eIF5A1とRPL10A、およびeIF5A2とRPL10Aの相互作用を分子動力学的計算により求めた結果、eIF5A2はeIF5A1に比べてRPL10Aとの相互作用が弱いことが示唆されました。以上の結果より、eIF5A2はeIF5A1とは異なるリボソーム、すなわちがん細胞の増殖に適応したリボソームE部位に相互作用することが考えられました (図1)。
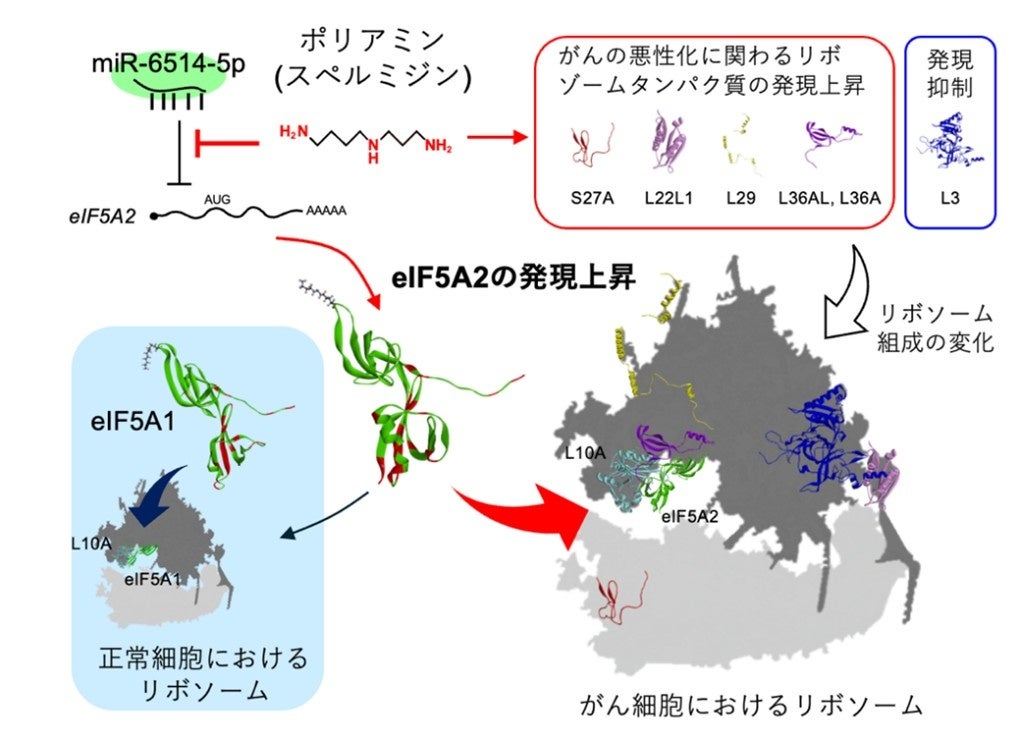
ポリアミンがeIF5A2の生合成を促進する仕組みを明らかにするため、eIF5A2の5′-UTR およびN末端コーディング領域を含む遺伝子に緑色蛍光タンパク質(EGFP)の遺伝子を融合させたレポーターアッセイシステムを構築しました。HeLa S3細胞にEIF5A2-EGFP融合遺伝子を発現させ、DFMO処理を行ったところ、融合タンパク質量は減少した一方で、mRNA量は変化しませんでした。この結果は、ポリアミンによるeIF5A2合成促進が翻訳開始段階で起こることを示唆しています。次に、特定のmiRNAがeIF5A2の翻訳を抑えているかを検証するため、eIF5A2の5'-UTR領域をmiRNAに関するデータベースを使って調査したところ、この領域には3種類のmiRNAが結合する可能性があることがわかりました。そこで、これら3種のmiRNAと結合できなくなるようにそれぞれ変異を入れた変異型EIF5A2-EGFP融合遺伝子をHeLa S3細胞に発現させ、DFMO処理を行った結果、miR-6514-5pの結合部に変異を導入した変異型EIF5A2-EGFP融合遺伝子から合成されるeIF5A2-EGFP融合タンパク質の発現は野生型よりも高く、DFMOに対する感受性も低下していました。また、miR6514-5pの阻害剤をHeLa S3に発現させ、DFMO処理を行った結果、内因性のeIF5A2の発現量が増加し、DFMOに対する感受性も低下しました。この結果から、ポリアミンはmiR-6514-5pによる翻訳抑制を解除することで、eIF5A2のタンパク質合成を促進していることが明らかになりました (図1)。
※本研究は、日本学術振興会(JSPS)の科研費(基盤研究C)(18K06652)、濱口生化学振興財団および金沢大学がん進展制御研究所の学外共同研究助成金の助成を受けて実施されました。
【用語】
*1 DFMO処理: ポリアミン合成を阻害するDFMO(α-Difluoromethylornithine)という化合物で処理することを指す
*2 ボルケーノプロット: 遺伝子発現解析やプロテオーム解析などで使われるグラフ
*3 siRNA: 細胞内で特定の遺伝子の発現を一時的に抑える技術
*4 酸素消費速度(OCR): 細胞や組織がどれくらい酸素を使ってエネルギーを産生しているかを示す指標。主にミトコンドリアの呼吸活性(酸化的リン酸化)を評価するために用いられる
*5 細胞外酸性化速度(ECAR): 細胞が解糖系を通じてどれだけ乳酸を生成しているかを示す指標
【論文情報】
雑誌名:Journal of Biological Chemistry
論文タイトル:Polyamines stimulate the protein synthesis of the initiation factor eIF5A2 participating in mRNA decoding distinct from eIF5A1
著者:Masato Suzuki, Takehiro Suzuki, Yoshio Nakano, Ken Matsumoto, Hitomi Manaka, Masahiro Komeno, Shoma Tamori, Akira Sato, Naoshi Dohmae, Kazunori Akimoto, Satoru Miyazaki, Takashi Suda, Toshihiko Toida, Keiko Kashiwagi, Kazuei Igarashi, Kyohei Higashi
※PR TIMESのシステムでは上付き・下付き文字や特殊文字等を使用できないため、正式な表記と異なる場合がございますのでご留意ください。正式な表記は、東京理科大学WEBページ(https://www.tus.ac.jp/today/archive/20250827_8803.html)をご参照ください。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
