すい臓がんの進行を抑える可能性のある遺伝子を発見 ~『沈黙のがん』すい臓がんの早期診断や治療に光~
【研究の要旨とポイント】
骨代謝などで重要な役割を果たす脱リン酸化酵素CTDNEP1が、すい臓がんの進行を抑える「がん抑制遺伝子」としての働きを持つことを世界ではじめて発見しました。
すい臓がんの予後を予測するバイオマーカーや、新たな治療ターゲットとしての応用可能性を示唆しています。
発見が難しく、治療法も限られるすい臓がんの克服に向けた一歩となることが期待されます。
【研究の概要】
東京理科大学 薬学部生命創薬科学科の早田 匡芳教授、薬学研究科 薬科学専攻の新居 真由香氏(博士後期課程2年)は、脱リン酸化酵素CTDNEP1(*1)がすい臓がんの進行を抑える「がん抑制遺伝子」として働いている可能性を世界ではじめて発見しました。
CTDNEP1は、これまでに骨の代謝や小児の脳腫瘍(髄芽腫)に関与することが知られていましたが、他のがんにおける役割は分かっていませんでした。
すい臓がんは、早期発見が難しく治療の選択肢も限られていることから、最も予後の厳しいがんの一つとして知られています。そこで本研究では、すい臓がん患者の遺伝子データを解析し、CTDNEP1の発現量と患者の予後との関係を調べました。
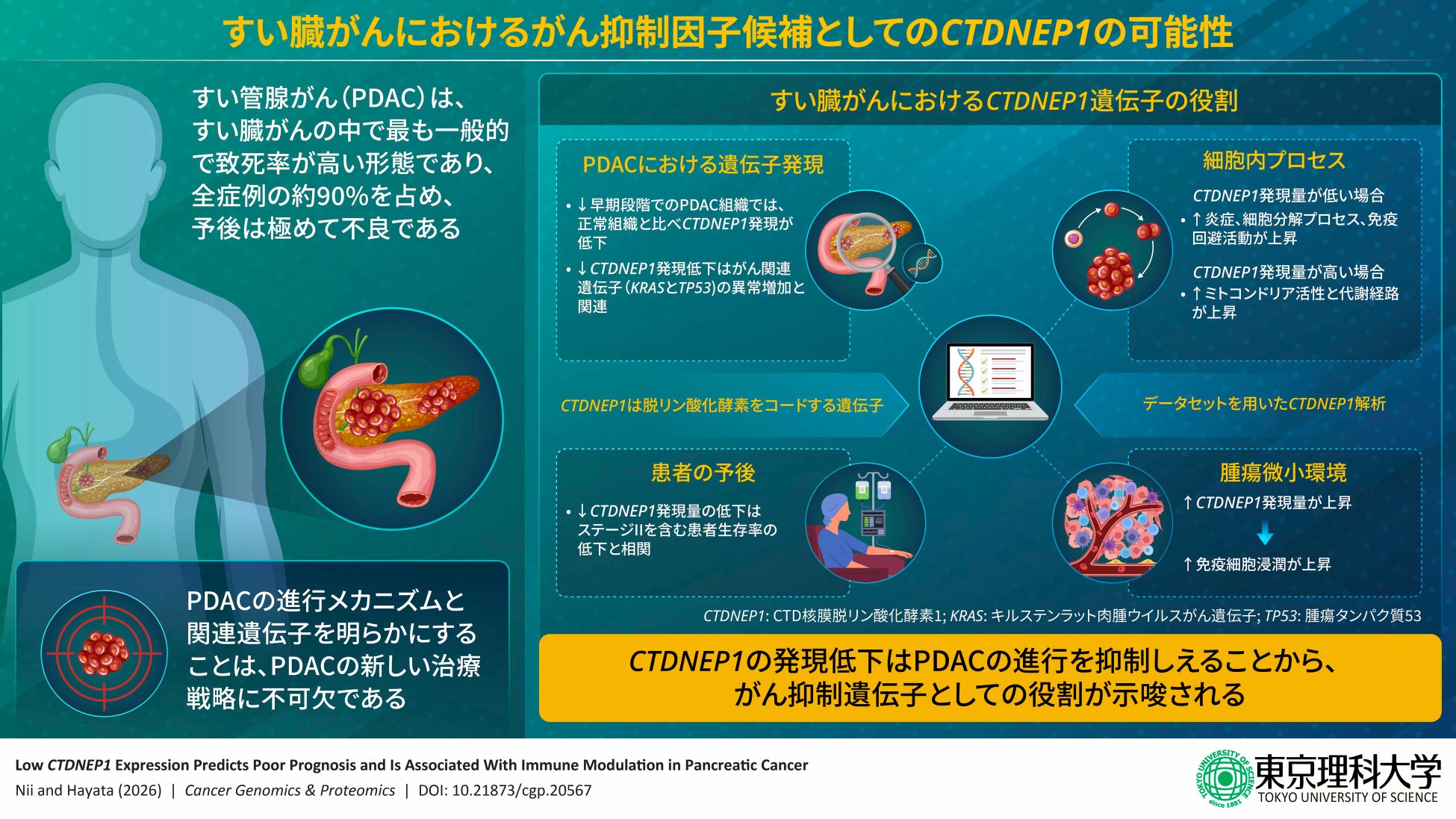
その結果、すい臓がん組織ではCTDNEP1の発現量が正常組織と比べて著しく低下しており、発現が低い患者ほど生存率が低いことが明らかになりました。また、CTDNEP1の発現が高いほど、がん組織に免疫細胞が多く集まっていることも確認され、CTDNEP1が腫瘍の免疫環境にも影響を与えている可能性が示唆されました。
本研究の成果は、CTDNEP1がすい臓がんの予後を予測するバイオマーカー(*2)や新たな治療標的となる可能性を示しており、早期発見や新しい治療法の開発につながることが期待されます。
本研究成果は、2026年1月1日に国際学術誌「Cancer Genomics & Proteomics」にオンライン掲載されました。
【研究の背景】
すい臓がん(すい管腺がん:PDAC)は、全てのがんの中で最も致死率が高く、極めて予後が悪いがんの一つです。
初期にはほとんど自覚症状がなく、発見された時点ですでに進行しているケースが多いことや、有効な治療法が限られていることが、その大きな要因となっています。そのため、すい臓がんの早期診断や治療に役立つ研究が強く求められています。
すい臓がんの発生・進行には、KRAS、TP53、CDKN2A、SMAD4といった遺伝子の異常が深く関わっていることが知られています。これらの遺伝子に変異が蓄積することで、正常な細胞ががん化し、悪性度が増していきます。
しかし、これらの遺伝子だけでは、すい臓がんの複雑な進行メカニズムを十分に説明することはできておらず、重要な役割を果たす遺伝子が他にも存在することが示唆されていました。早期診断に役立つ新たなバイオマーカー開発のためにも、すい臓がんの進行や抑制に関わる遺伝子の発見が急務となっています。
CTDNEP1は細胞内のシグナル伝達(*3)を調節する脱リン酸化酵素の設計図となる遺伝子です。早田教授らはこれまでに、この遺伝子が骨格や神経の発生、腎臓や卵巣の機能維持、さらには破骨細胞の分化抑制に関わることを明らかにしてきました。また、小児の悪性脳腫瘍である髄芽腫において、CTDNEP1の欠損が腫瘍発生に関与することが他の研究グループから報告されており、腫瘍(がん)抑制遺伝子としての可能性が示唆されていました。
しかし、すい臓がんをはじめとする他の悪性腫瘍におけるCTDNEP1の役割については、これまでほとんど研究されていませんでした。
そこで本研究では、すい臓がんにおけるCTDNEP1の発現状況と、患者の予後や腫瘍の特性との関連を明らかにすることを目的としました。
【研究結果の詳細】
本研究は、公開されている大規模なアメリカのがんゲノム研究データベース(The Cancer Genome Atlas ; TCGA)に登録されていたすい臓がん患者サンプルにおけるmRNA発現レベル(n=177)、全生存期間(n=177)、疾患特異的生存期間(n=171)、無病生存期間(n=69)、無増悪生存期間(PFI)(n=177)、遺伝子変異(n=177)、コピー数変異(n=176)を対象に解析を行いました。
まず、61種類のがんと正常組織間でCTDNEP1の発現量を比較したところ、すい臓がんを含む複数のがんでCTDNEP1の発現が有意に低下していることが分かりました。
その中からすい臓がんに焦点を当て、進行ステージごとに解析すると、ステージIの早期段階からすでにCTDNEP1の発現が著しく低下していました。
さらに、すい臓がんの発生・進行に関わるKRAS、TP53、CDKN2A、SMAD4といった遺伝子に変異や欠失がある腫瘍では、CTDNEP1の発現がより低いことも確認されました。これらの結果は、CTDNEP1の発現低下がすい臓がんの早い段階から生じている可能性を示しています。
次に、CTDNEP1の発現量が患者の生存に影響するかを検証するため、患者をCTDNEP1高発現群と低発現群に分けて生存率を比較しました。結果、CTDNEP1低発現群は高発現群と比べて全生存率、疾患特異的生存率、無病生存率のいずれも有意に低いことが分かりました。特にステージIIのすい臓がん患者において、この傾向が顕著に見られました。
また、遺伝子機能の解析から、CTDNEP1低発現群では免疫・炎症反応やタンパク質分解に関わる経路が活性化しており、高発現群ではミトコンドリアの代謝やエネルギー産生に関わる経路やエネルギー代謝に関わる経路が活性化していることが分かりました。
さらに、CTDNEP1が腫瘍の免疫環境に影響を与えているかを調べたところ、CTDNEP1の発現が高いほど、CD4+ T細胞、マクロファージ、好中球、樹状細胞など複数の免疫細胞が腫瘍内により多く集まっていることが確認されました。この結果は、CTDNEP1の発現低下が免疫細胞の浸潤を減少させ、がんの免疫逃避に関与している可能性を示唆しています。
これらの結果は、CTDNEP1がすい臓がんの進行を抑える「がん抑制遺伝子」として機能している可能性を示しています。CTDNEP1は、すい臓がんの予後を予測するバイオマーカーや、新たな治療標的としての可能性を持っており、今後の研究によって早期診断や新しい治療法の開発につながることが期待されます。
【今後の展望】
本研究は米国の公開データベースを用いた相関解析に基づいたものであり、CTDNEP1のすい臓がん進行におけるメカニズムは明らかになっていません。今後は、細胞実験や動物実験を通じて、CTDNEP1がすい臓がん細胞の増殖や転移、免疫環境にどのように影響を与えるのかを検証することが必要です。CTDNEP1の発現を制御する因子や、シグナル経路を解明することで、新たな治療標的の発見につながる可能性があります。
将来的にはCTDNEP1がすい臓がんの予後を予測するバイオマーカーとして臨床応用でき、さらにはCTDNEP1を標的とした新しい治療法の開発につながる可能性があり、今後さらなる研究が必要です。すい臓がんは早期発見が難しく、有効な治療法も限られているため、本研究の成果がこの難治性がんの克服に向けた一歩となることが望まれます。
早田教授は本研究について、「私はこれまで約20年間、CTDNEP1の機能について研究を続けてきました。骨の代謝や腎臓・卵巣の機能など、さまざまな分野でこの遺伝子の役割を明らかにしてきましたが、がんとの関係についてはまだ十分に分かっていませんでした。私自身、すい臓がんで若くして亡くなった知人が何人もおり、この病気の厳しさを身近に感じてきました。今回の研究が、すい臓がんの早期発見や新しい治療法の開発につながる第一歩になればと願っています」とコメントしています。
【用語】
*1 脱リン酸化酵素 CTDNEP1
タンパク質からリン酸基を取り除く酵素。細胞内シグナル伝達を調節する役割を持つ。CTDNEP1は脱リン酸化酵素の一種。健康体では正常に発現し、さまざまな臓器の機能維持に関わっている。
*2 バイオマーカー
病気の有無や進行度合、治療の効果などを示す生体内物質や遺伝子。
*3 シグナル伝達
細胞が外部から刺激を受け、細胞内に情報を伝える仕組み。細胞の増殖や分化、死などを制御している。
【論文情報】

|
雑誌名 |
:Cancer Genomics & Proteomics |
|
論文タイトル |
:Low CTDNEP1 Expression Predicts Poor Prognosis and Is Associated With Immune Modulation in Pancreatic Cancer |
|
著者 |
:Mayuka Nii, Tadayoshi Hayata |
|
DOI |
※PR TIMESのシステムでは上付き・下付き文字や特殊文字等を使用できないため、正式な表記と異なる場合がございますのでご留意ください。正式な表記は、東京理科大学WEBページ(https://www.tus.ac.jp/today/archive/20260114_7413.html)をご参照ください。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
