【ファンケル】生きた細胞内のタンパク質発現量を推定するAI技術を開発
なお、本研究は学術雑誌BioengineeringのMachine Learning and Artificial Intelligence for Biomedical Applications, 2nd Edition ※1に掲載されました。
本成果は、培養した細胞を用いた研究に幅広く応用が可能であり、成分の有効性や安全性評価、老化のメカニズムなどの研究に生かしてまいります。
【生きたままの状態で複数の細胞内タンパク質発現量を推定する技術の開発】
<細胞内のタンパク質発現をAIで推定する>
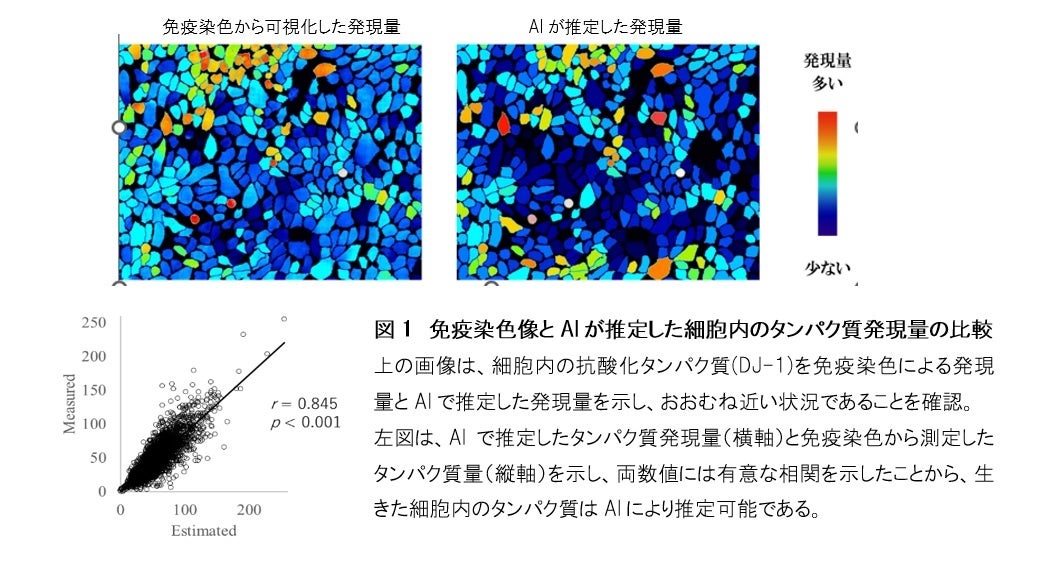
通常細胞内のタンパク質発現を観察するには、免疫染色法※2という手法を用いています。免疫染色法は、ターゲットとするタンパク質を抗原抗体反応※3により染色して観察を行いますが、同時に観察可能なタンパク質の種類は2~4種類までと限定されています。さらに実験過程で細胞を固定※4する必要があるため、細胞が生きたままの状態で、タンパク質の観察は不可能でした。
そこで本研究では、細胞を生きたままの状態で細胞内のタンパク質を観察する方法の開発を目指しました。細胞にダメージを与えず撮像可能な位相差法※5による細胞の画像(位相差像)と、免疫染色法により細胞内のタンパク質を可視化した画像(免疫染色像)を機械学習させ、位相差像から免疫染色像を推定するAIモデルを構築しました。その結果、このAIモデルによる位相差像から、生きたままの状態で特定のタンパク質発現量を示す免疫染色像を推定することが可能となりました。
※1 Bioengineering:本記事はBioengineering 2024, 11(8), 774; https://doi.org/10.3390/bioengineering11080774に掲載されています。
※2 免疫染色法:細胞内の特定のタンパク質を抗原抗体反応により染色して可視化する技術。観察には細胞を固定(生体活動を止める)する必要がある。
※3 抗原抗体反応:抗原(主に体内のタンパク質)と、そのタンパク質にだけ反応する抗体が結合すること。
※4 固定:細胞の生命活動を不可逆的に停止させること。
※5 位相差法:光学顕微鏡を用いて、光の回折、干渉を利用して、細胞内外の形態を観察するための方法。細胞を染色することなく、生きたままの状態で観察することが可能であり、細胞へのダメージも低いが、特定のタンパク質の発現量を観察することはできない。
この手法を用いて、ヒト表皮細胞※6による分化、炎症、老化、抗酸化※7に関わる細胞内に発現するタンパク質について検討を行いました。まず細胞の位相差像とそれぞれのタンパク質の免疫染色像を機械学習し、AIによる推定を行いました。その結果、免疫染色像から得られる各タンパク質の発現量と位相差像からAIが推定した発現量との関係がおおよそ一致しており、相関関係が確認されたことから、細胞内の発現量は、AIにより推定可能であることが示されました(図1)。
さらに、同手法を複数種のタンパク質に対して繰り返し行うことにより、一つの位相差画像から、複数のタンパク質を推定するAIモデルを構築いたしました。
※6 ヒト表皮細胞:ヒト皮膚から単離された細胞で、皮膚の最外層である表皮を形成する細胞。外環境から体内を守るバリア機能を担う。
※7 分化、炎症、老化、抗酸化:本研究では、分化の指標タンパク質としてHsp27, GAL7、炎症としてInterleukin-1α (IL-1α), IL-6, NFkB、老化としてp21, p53, β-galactosidase (GLB1)、抗酸化としてDJ-1を用いている。
<ライブセルイメージング※8への応用>
本推定AIモデルは、細胞を生きたままの状態で複数のタンパク質を推定できることから、生きた状態で細胞内のタンパク質発現の経時変化をタイムラプス画像※9として見ることが可能となりました。そのため細胞内で起こるタンパク質の分化、炎症、老化や抗酸化などに関わる変化や、細胞の移動などの挙動と同時に時間を追って解析することに成功しました(図2および動画)。
※8 ライブセルイメージング:細胞を生きたままの状態で観察する方法。細胞内の構造や動きを観察することはできるが、細胞内に発現するタンパク質の変化を捉えることは困難。
※9 タイムラプス画像:一定の時間間隔を空けて連続的に撮影した画像。

図2 AIによる複数タンパク質の発現量の推定とタイムラプス画像
位相差像(左上)と細胞の核と細胞形状の蛍光像(右上)、およびAIによる分化(Hsp27, GAL7)、炎症(Interleukin-1α (IL-1α), IL-6, NFkB)、老化(p21, p53, β-galactosidase (GLB1))、抗酸化(DJ-1)の指標となる各タンパク質の推定像。
AIによる複数タンパク質の発現を推定するタイムラプス動画

【研究背景・目的】
私たちの身体には、約37兆個の細胞が存在し、個々の細胞がそれぞれの特徴や環境に応じて変化し、細胞間でコミュニケーションを行いながら、生体の恒常性維持に寄与しています。細胞が織りなすさまざまな現象を理解するためには、個々の細胞の動きや細胞同士のコミュニケーションを観察しながら、細胞内でどのような変化が起きているか、経時的に解析することが重要と考えられます。近年、培養細胞の解析技術も発展は目覚ましく、免疫染色、ライブセルイメージング、次世代シーケンス※10、シングルセル解析※11などさまざまな手法が開発され、応用されています。しかし、細胞や細胞間の動きと細胞内の遺伝子やタンパク質の発現量を包括的、かつ経時的に解析することはいまだに困難です。
本研究は、顕微鏡撮像と機械学習によるAI技術を用い、生きたままの状態で細胞内のタンパク質発現量を推定する技術の確立を行いました。
※10 次世代シーケンス:数千から数百万のDNA配列を同時に読み取る最先端の遺伝子解析技術。複数個体の遺伝子配列を同時に出力できるなど高速な処理が可能であり、個別化医療にも応用されている。細胞を生きたまま解析することはできない。
※11 シングルセル解析:従来の技術では、複数細胞の遺伝子をまとめて抽出し、遺伝子発現量の平均値を解析していたのに対して、一つひとつの細胞の遺伝子発現を個別に解析する技術。細胞を生きたまま解析することはできない。
【今後の展開】
本研究で確立した細胞内のタンパク質発現量を推定する新たなAI技術は、老化メカニズムの解明、皮膚科学理論の構築や素材成分の有効性試験・安全性試験など広く応用可能です。同技術を活用し、新たな生命現象の解明とそれを基にした次世代の美と健康の理論構築を進めてまいります。
【担当者のコメント】

株式会社ファンケル 総合研究所 基盤技術研究センター 生体機能分析グループ
主任研究員 東ヶ崎 健 (とうがさき たけし)
私たちの生体内では、細胞が社会を形成しているかのように、相互に影響をしあい、秩序を保ちながら生体活動を担っています。そのため、細胞たちが織りなすさまざまな現象を理解するには、細胞が生きている状態で、どのように細胞間でコミュニケーションをし、個々の細胞が状態変化をしているのか知ることが重要だと考えられます。
これまでの実験方法では、細胞を解析するために、細胞の採取や生体活動を止めて観察する必要がありました。しかし、本技術は細胞を生きた状態で細胞内のタンパク質発現変化を観察することができ、細胞間のコミュニケーションやその影響を可視化することができます。
今後新たな細胞実験の技術として、細胞老化などのメカニズム研究に応用していきたいと思います。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
