糖質加水分解酵素群の100年を超える研究の歴史の中で初めて見つかった糖転移反応 ~植物に対する病原性因子の環状糖を合成するアノマー反転型糖転移反応の発見~
【研究の要旨とポイント】
植物病原菌Xanthomonas campestris pv. campestris由来の糖質加水分解酵素(GH)ホモログが、「常識」を覆すユニークな糖転移反応により病原性に必須な糖鎖「α-1,6-cyclized β-1,2-glucohexadecaose(CβG16α)」を合成することを示しました。
この反応は、100年以上のGHの研究の歴史で初めて見つかった「アノマー反転型糖転移反応」です。立体構造に基づいてこの反応が可能であると解明したことにより、「酵素を利用した糖鎖利用の可能性」を大幅に広げたと言えます。またこの酵素自体が全く新しいコンセプトの農薬の阻害ターゲットとして将来的に期待されます。
本酵素の発見は既存のGH酵素の機能構造相関の観察に基づいており、「反応機構」に着目することの重要性を示す好例と言えます。
【研究の概要】
東京理科大学大学院 創域理工学研究科生命生物科学専攻の元内 省氏(博士課程2年、日本学術振興会 特別研究員)、同大学 創域理工学部生命生物科学科の中島 将博准教授、農研機構 食品研究部門の今場 司朗上級研究員、新潟大学 農学部農学科の中井 博之准教授の研究グループは、これまでアノマー保持型糖質加水分解酵素にしか見つかっていなかった糖転移反応を、アノマー反転型糖質加水分解酵素で発見しました。これは、糖質加水分解酵素研究の100年以上の歴史の中で、初めて見つかったタイプの糖転移反応です(図1)。
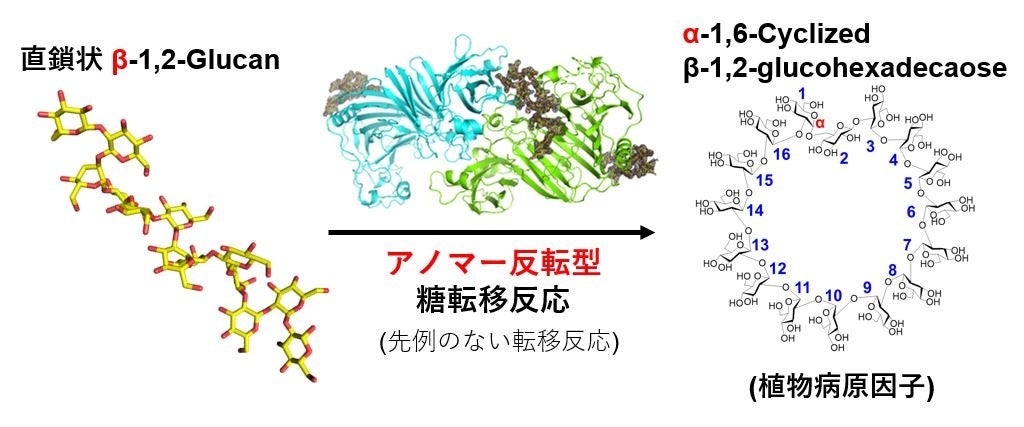
図1. 本研究で発見した酵素の反応。
糖質加水分解酵素群は、反応前後でアノマー型が保持されるか反転するかで、アノマー保持型とアノマー反転型に大別されます(*1)。また、この酵素群は基質に水がアタックするか、糖鎖がアタックするかで加水分解反応と糖転移反応に分類され、理論的には4種類の反応に分けられます(図2)。糖転移反応は生体内で重要な役割を果たす反応の一つであり、糖鎖合成のツールとしても利用価値の高い反応ですが、アノマー保持型でしか見つかっていませんでした。
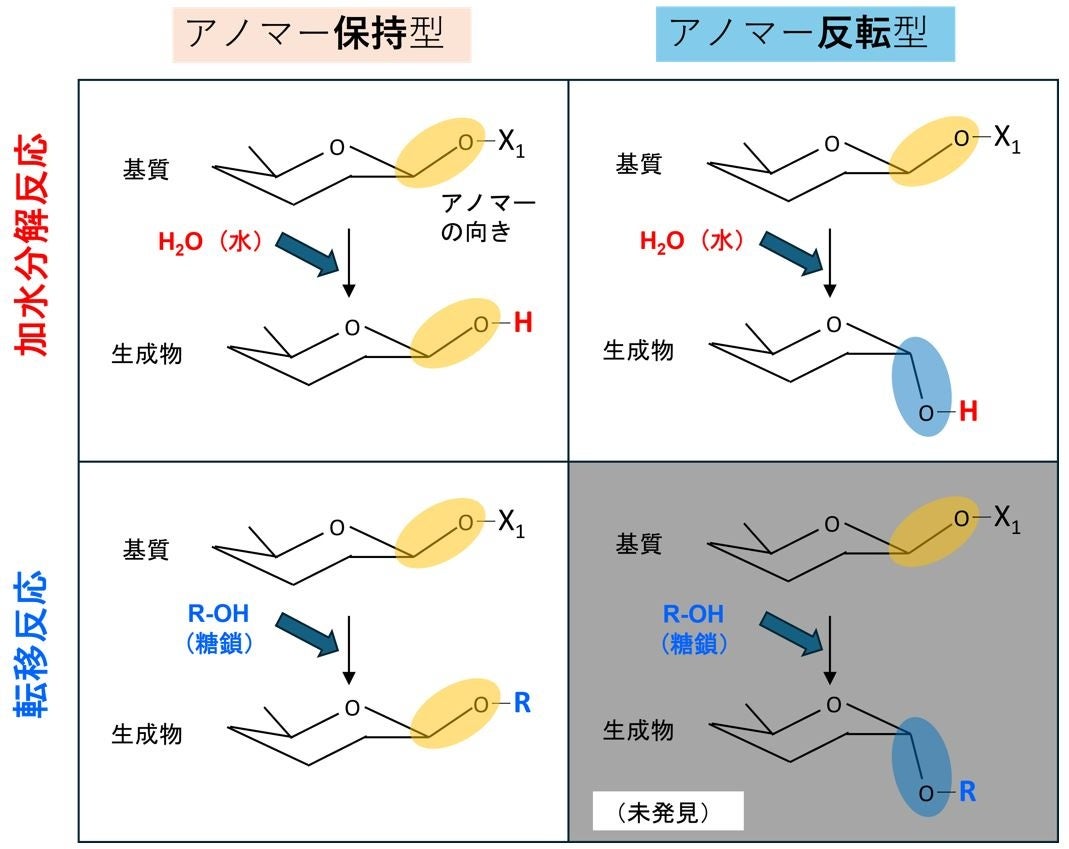
図2. 一般的な糖質加水分解酵素群の反応の分類の模式図。
(構造、反応の一部は簡略化)
本研究では、Xanthomonas campestris pv. campestris(以下、Xcc)によるモデル植物(シロイヌナズナやタバコ)への病原性発現に重要なことで知られるα-1,6-cyclized β-1,2-glucohexadecaose(CβG16α)の生合成に関連する酵素について研究を行いました。その結果、Xcc由来酵素XccOpgDが直鎖状β-1,2-gulcanをCβG16αに変換することを発見しました。また、立体構造解析も行い、この酵素がβ-グリコシド結合をα-グリコシド結合に変換して糖鎖の転移を行うメカニズムを明確に証明しました(図3)。これは、アノマー反転型にも糖転移反応が存在することを示す初めての結果であり、酵素を利用した糖鎖合成の可能性を大きく飛躍させる発見と言えます。
さらに、この反応により合成される糖鎖は、多様なグラム陰性菌の病原性発現に深く関わる物質です。そのため、将来的には今回発見した糖鎖ホモログ群をターゲットとした、殺菌することなく病原性を阻害できる、新しいコンセプトの農薬の創成につながる可能性があります。
本研究成果は、2024年6月19日に国際学術誌「Journal of the American Chemical Society」にオンライン掲載されました。
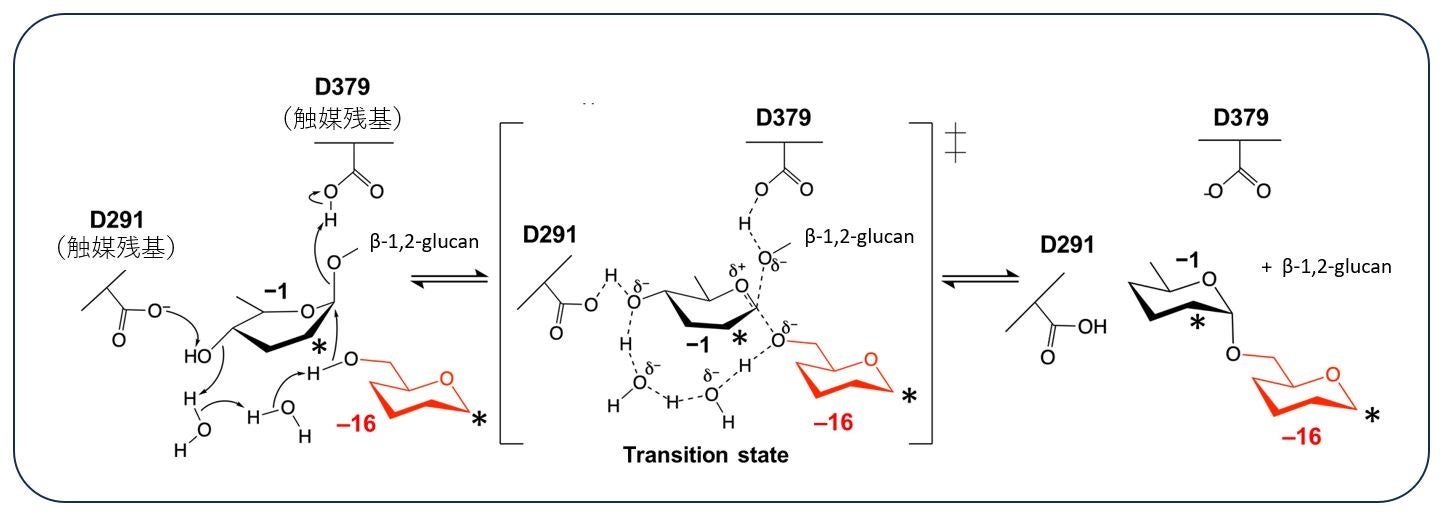
図3. 本研究で発見されたアノマー反転型の糖転移反応。
*2個のアスタリスクは、−1と−16の位置のグルコース単位がアスタリスクの位置で14個のグルコース単位を挟んでつながっていることを表している。
【研究の背景】
糖鎖は非常に複雑で多彩な構造を持ち、それゆえに自然界や生体内で多様な役割を果たしています。糖鎖は酵素によって合成・分解されますが、糖鎖に作用する酵素も機能と構造も糖鎖の複雑さに対応して非常に多様です。そのため、未知の酵素が依然として多数存在し、その中から有用な機能を持つ酵素も見出されるであろうと考えられます。
本研究では、薬剤耐性を獲得した植物病害菌に対応できる新たなコンセプトの農薬開発を視野に、Xccを対象とした研究を行いました。Xccを含むキサントモナス属細菌の多くは植物病原性を持ち、イネ、コムギ、トマトなどをはじめとする400種以上の植物に病害を引き起こすことが知られています。こうした病害を防ぐために殺菌剤が広く使用されていますが、耐性菌の出現が大きな問題となっています。
Xccが産生するα-1,6-cyclized β-1,2-glucohexadecaose(CβG16α)は、モデル植物であるシロイヌナズナやベンサミアナ(タバコ)に対する病原性発現に不可欠な物質である一方で、Xcc自身はCβG16αを産生しなくても増殖できることが知られています。そのため、CβG16αは耐性菌を生み出さない新たなコンセプトの農薬となる可能性があり、新たな創薬ターゲットとなるポテンシャルを秘めています。
CβG16αはOPG(osmo-regulated periplasmic glucans)に分類される多糖です。β-1,2結合グルコシル骨格を持つOPGは、α-1,6-cyclized β-1,2-glucooligosaccharide、cyclic β-1,2-glucan (CβG)、β-1,6- glucose側鎖を持つβ-1,2-glucooligosaccharide (LβG-6β)というパターンに大別され、これまでに、OPGの生合成に関連する遺伝子を変異させたさまざまな変異株の表現型が解析されています。これらの変異株の多くは、病原性の欠如や共生能力の欠如など、野生型とは大きく異なる表現型を示すことが報告されています。
最近、本研究グループはLβG-6β合成に重要と示唆されていた大腸菌のタンパク質OpgGおよびOpgD (EcOpgD) がβ-1,2-glucanを分解するβ-1,2-glucanase(SGL)であることを見出し、OpgDがLβG-6βの鎖長の調節を担うことを生化学的に証明しました(※1)。これらは既知のGHファミリーとはアミノ酸配列、構造が全く異なるため、新しいタイプの酵素群(以降GH186ファミリー)であることが示されました。OpgDはその反応経路においてGHに前例のない長さの水分子同士のプロトンリレーを採用していました。しかし、この水分子の経路を安定に保つために重要な構造領域のアミノ酸配列がGH186ファミリー内ではごく限られた範囲でしか保存されていないことから(図4)、研究グループはこのファミリー内で酵素機能や反応機構が多様性に富んでいる可能性に着目しました。そこで本研究では、CβG16αの生合成にXcc由来のGH186ホモログであるXccOpgDが関与するのではと考え、その詳細な機能解析を行うこととしました。
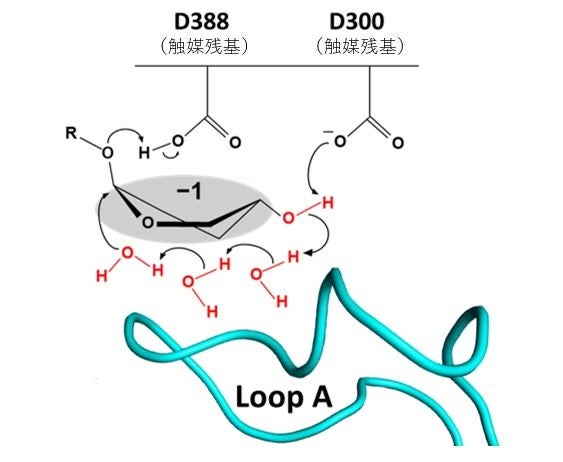
図4. 大腸菌由来EcOpgDにおける酵素反応経路の模式図。
Loop Aは水分子の経路を安定に保つために重要な構造領域。
※1 東京理科大学プレスリリース『細菌の病原性などに関わる糖鎖「OPG」の新規の生合成酵素を発見 ~新たな創薬ターゲットとなる可能性~』
https://www.tus.ac.jp/today/archive/20231012_1221.html
【研究結果の詳細】
大腸菌を宿主として生産した組換えXccOpgDを直鎖状β-1,2-glucanと作用させると、重合度が単一の糖鎖産物が特異的に生成されました。さらに生成物の質量分析、NMR分析によりその化学構造を決定したところ、この生成物は側鎖を持たない16個のグルコース単位からなるα-1,6-cyclized β-1,2-glucan(CβG16α)と同定されました。このことから、XccOpgDはβグリコシド結合をαグリコシド結合につなぎかえる新規のアノマー反転型糖転移反応を触媒することが示されました。
続いて、この前例のない反応のメカニズムを解明するためにXccOpgDの酵素-基質複合体の構造をX線結晶構造解析により決定しました。その結果、22個のグルコース単位からなる直鎖状β-1,2-glucanの電子密度(*2)が触媒クレフトにおいてはっきりと観察され、さらに、16個のグルコース単位がちょうど環状になるように配置されていました(図5の−1から−16のグルコース単位)。
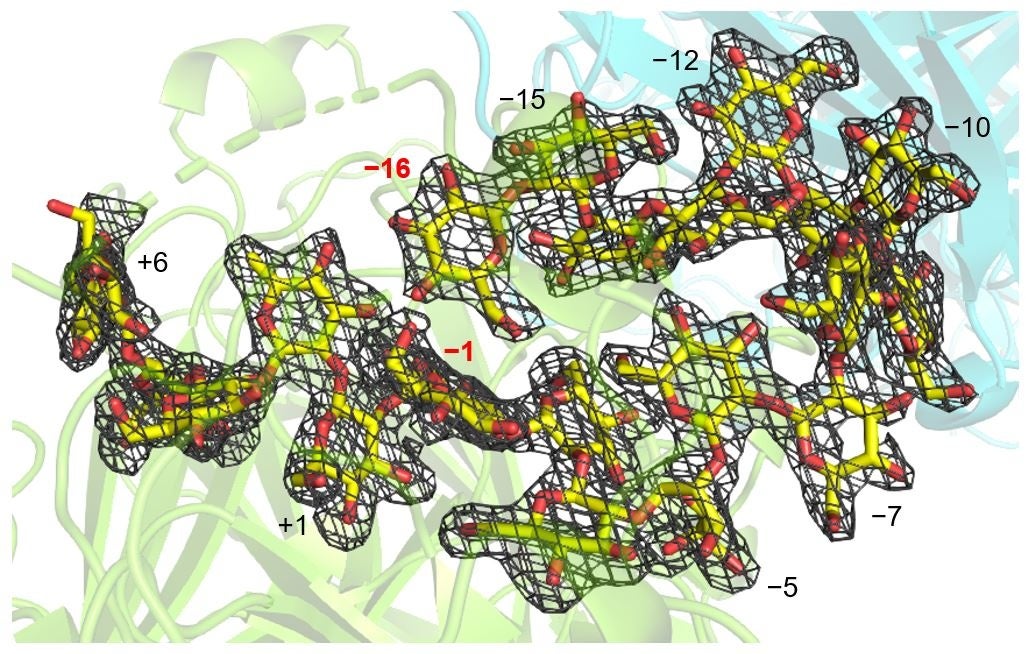
図5. XccOpgDとβ-1,2-glucanとの複合体構造における基質の電子密度。
数字はグルコース単位の位置の番号。反応の生じる単糖単位同士の結合からそれぞれの方向へ+1、+2‥、−1、−2‥と順に番号が付けられている。
アノマー反転型の加水分解酵素である大腸菌由来EcOpgDとXccOpgDの構造を比較すると、EcOpgDでは基質に求核攻撃を行う水分子がはっきりと観察されるため、加水分解反応に適した環境になっていることが分かるのに対し、XccOpgDではそれに対応する水分子(求核水)が観察されませんでした(図6)。その代わりにXccOpgDでは、求核攻撃に適した位置の近傍に、基質である直鎖状β-1,2-グルカンの還元末端のグルコース単位の6位ヒドロキシ基が存在していることが分かりました。これは、この位置で酵素反応によりα-1,6-グリコシド結合が生じることを示しており、XccOpgDの新規な糖転移反応のメカニズムが立体構造により明確に証明されたと言えます。
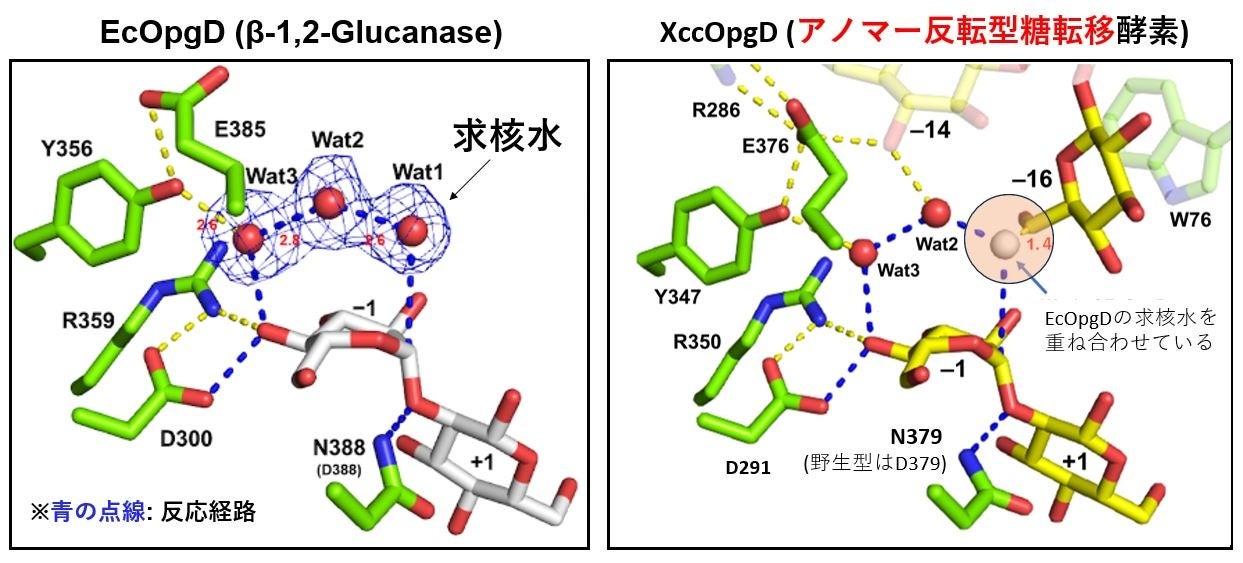
図6. EcOpgDとXccOpgDとの反応メカニズムの比較
両者の反応経路の違いは求核種の違いのみ。
本研究を主導した中島准教授と元内氏は「今回発見した酵素の反応は、β-1,2-グルコシド結合をα-1,6-グルコシド結合につなぎ変える史上初のアノマー反転型糖転移反応です。この反応の発見はGH酵素の反応メカニズムの基本原理の部分の発見であり、酵素を利用した『糖鎖合成』の新たな可能性が大きく広がったと言えます。また、今回発見した酵素のホモログ群は薬剤耐性菌問題の解決に寄与する農薬の阻害ターゲットとなりうるため、XccOpgDの機能構造相関の情報は構造ベース創薬の基礎基盤になると期待されます」とコメントしています。
※本研究は、JST 次世代研究者挑戦的研究プログラム(JPMJSP2151)の助成を受けて実施されました。
【用語】
*1 アノマー保持型、アノマー反転型
グリコシド結合を加水分解する酵素反応のうち、基質のアノマー型と生成物のアノマー型が同じものをアノマー保持型、異なるものをアノマー反転型という。アノマーとは、糖が5員環(フラノース)または6員環(ピラノース)の環状構造をとるときに新たに生じるヒドロキシ基の向きに由来する立体異性体の関係を示す用語。
*2 X線結晶構造解析と電子密度
タンパク質の結晶を作成し、それにX線を照射して得られる回折データから立体構造を得る手法。この解析では、各位置で電子がどの程度存在するか(電子密度)の情報が得られます。電子密度の高い場所が原子の存在する場所であり、主にメッシュで表示されます。
【論文情報】
雑誌名:Journal of the American Chemical Society
論文タイトル:Discovery of anomer-inverting transglycosylase: cyclic glucohexadecaose-producing enzyme from Xanthomonas, a phytopathogen
著者:Sei Motouchi, Shiro Komba, Hiroyuki Nakai, Masahiro Nakajima
DOI:10.1021/jacs.4c02579
URL:https://doi.org/10.1021/jacs.4c02579
【発表者】
元内 省 東京理科大学 創域理工学研究科 生命生物科学専攻 博士課程2年 <筆頭著者、責任著者>
今場 司朗 農研機構 食品研究部門 食品加工・素材研究領域 バイオ素材開発グループ 上級研究員
中井 博之 新潟大学 農学部 農学科 准教授
中島 将博 東京理科大学 創域理工学研究科 生命生物科学専攻 准教授 <責任著者>
【研究に関する問い合わせ先】
東京理科大学創域理工学研究科 生命生物科学専攻 准教授
中島 将博(なかじま まさひろ)
E-mail:m-nakajima【@】rs.tus.ac.jp
農研機構 食品研究部門 上級研究員
今場 司朗(こんば しろう)
お問い合わせフォーム:https://www.naro.go.jp/inquiry/index.html
新潟大学農学部農学科 准教授
中井 博之(なかい ひろゆき)
E-mail:nakai【@】agr.niigata-u.ac.jp
【報道・広報に関する問い合わせ先】
東京理科大学 経営企画部 広報課
TEL:03-5228-8107 FAX:03-3260-5823
E-mail:koho【@】admin.tus.ac.jp
農研機構 食品研究部門 研究推進部 研究推進室 渉外チーム
お問い合わせフォーム:https://www.naro.go.jp/inquiry/index.html
新潟大学 広報事務室
TEL:025-262-7000
Email:pr-office【@】adm.niigata-u.ac.jp
【@】は@にご変更ください。
すべての画像
