抗炎症免疫応答に寄与するRALDH2の発現を促す食品由来物質を同定 ~免疫疾患の新たな予防法開発につながる成果~
【研究の要旨とポイント】
樹状細胞はRALDH2によるレチノイン酸の合成を介して、過剰な免疫反応を抑える制御性T細胞の誘導を促進することから、腸管免疫系において重要な役割を果たしています。
今回、ポリフェノールの一種であるケンフェロールが、RALDH2発現・活性亢進作用を有することを突き止めました。
アレルギーや炎症、自己免疫疾患などの予防法や治療法の開発に寄与することが期待されます。
【研究の概要】
東京理科大学 先進工学部 生命システム工学科の西山 千春教授、高橋 美貴氏(2023年度修士課程修了)、長田 和樹助教、綿貫 優実氏(2019年度修士課程修了)らの研究グループは、レチナール脱水素酵素2 (retinal dehydrogenase 2; RALDH2)の発現や活性を亢進させる食品由来成分の探索を行い、野菜や果物、お茶などに含まれるポリフェノールの一種であるケンフェロールを見出しました。
RALDH2は、腸管に局在する樹状細胞(*1)において発現する、ビタミンA誘導体であるレチナールをレチノイン酸に変換する酵素です。樹状細胞はRALDH2によるレチノイン酸の合成を介して、過剰な免疫反応を抑える制御性T細胞の誘導を促進することから、腸管免疫系において重要な役割を果たしています。
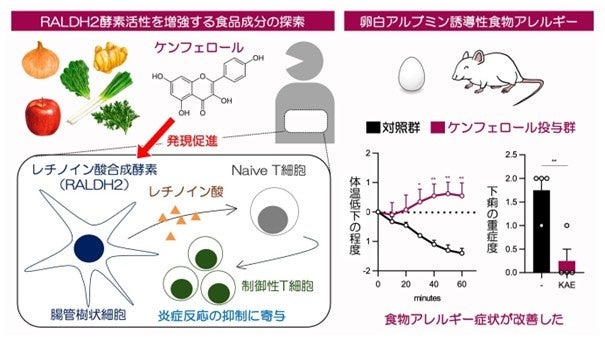
本研究グループは、約40種類の食品由来物質を対象にRALDH2発現誘導活性の比較を行い、ポリフェノールの一種であるケンフェロールが、RALDH2発現・活性亢進作用を有することを突き止めました(図1)。
さらに、ケンフェロールがRALDH2発現を上昇させる仕組みを調べた結果、内分泌撹乱物質(環境ホルモンと呼ばれることもあります)に反応する受容体である芳香族炭化水素受容体(AhR、*2)が関わることが示唆されました。さらに、研究グループは、過去の研究(※1)で樹状細胞におけるRALDH2遺伝子発現を制御する鍵分子として同定していた転写因子PU.1とIRF4についても、ケンフェロール刺激により発現や機能が亢進することも突き止めました。
※1 「樹状細胞におけるRALDH2の遺伝子発現を転写因子PU.1とIRF4が制御することを発見」
本研究では、ケンフェロールにターゲットを絞って作用機序の解析などを行いましたが、ケンフェロールと共通構造を有するケルセチンなどのフラボノイド類がスクリーニングの上位に並んでいました。このことは、ポリフェノールの共通構造が活性に関与していること、ケンフェロールだけでなくフラボノイド類全般に類似の活性があることを示唆する結果と考えられます。フラボノイド類は、いわゆるフィトケミカルとして、さまざまな野菜や果物から摂取することができる素材です。この結果は、ケンフェロールに限らず、フラボノイド類を積極的に日々の食材として取り入れることにより、過剰な免疫反応によって発症したり悪化したりするアレルギーや炎症、自己免疫疾患などの抑制につながる可能性を示すものです。
本研究成果は、2024年12月11日に国際学術誌「Allergy」にオンライン掲載されました。
【研究の背景】
本研究グループは、食品成分や腸内細菌代謝産物などによる免疫応答調節について研究しています。これまでに、短鎖脂肪酸がマスト細胞活性化を抑制することによってアレルギー疾患を緩和すること(※2)や、油の成分が、腸管内で新たな化合物に変換され、抗炎症効果を発揮すること(※3)など、幅広い知見を積み重ねてきました。
※2 「短鎖脂肪酸がアレルギーを抑制する作用機構を解明 ~アレルギーに対する食物繊維の有効性を分子レベルで実証~」
https://www.tus.ac.jp/today/archive/20240201_2581.html
※3 「腸内乳酸菌による脂肪酸代謝産物が抗炎症作用を示し炎症性腸疾患を緩和することを明らかに ~食用油に由来する成分の効能を遺伝子、細胞、個体レベルで解析~」
https://www.tus.ac.jp/today/archive/20240507_5656.html
今回、西山教授らはRALDH2に着目しました。RALDH2はAldh1a2遺伝子にコードさている酵素で、腸間膜リンパ節の樹状細胞に発現しています。ビタミンA誘導体であるレチナールをレチノイン酸に変換することで、制御性T細胞の誘導を促進します。近年の研究から、樹状細胞におけるRALDH2の遺伝子発現や機能の亢進は、全身的な抗炎症免疫応答に寄与することがわかりつつあります。こうした背景を踏まえ、本研究グループは、RALDH2の活性上昇を促進する食品成分を探索しました。
【研究結果の詳細】
約40種類の食品由来物質を対象にスクリーニングを行い、樹状細胞において、RALDH2をコードするAldh1a2 mRNAレベルを最も効果的に増加させる化合物として、フラボノイドの一種であるケンフェロールを同定しました。
抗原提示細胞によって引き起こされるナイーブCD4陽性T細胞(*3)からFoxp3陽性細胞(*4)への変換は、ケンフェロール存在下で増強され、樹状細胞のみをケンフェロールで前処理した場合にも増加しました。このことから、ケンフェロール処理によって、樹状細胞が持つ制御性T細胞誘導活性が増強されたことが示唆されました(図1左)。
次に、ケンフェロールの作用の分子メカニズムを調べるために、ケンフェロールの標的として報告されている芳香族炭化水素受容体(AhR)に着目し、解析を行いました。その結果、ケンフェロールがAhRに拮抗することによってAldh1a2遺伝子の発現が上昇することが示唆されました。
さらに、樹状細胞におけるRALDH2遺伝子発現を制御する鍵分子である転写因子PU.1とIRF4の発現や機能に対して、ケンフェロールが与える影響についても調べた結果、ケンフェロール刺激により、PU.1とIRF4いずれも発現や機能が亢進することも突き止めました。
これは、ケンフェロールはAhRのアゴニストである内分泌撹乱物質と拮抗的にはたらくアンタゴニスト活性を有し、PU.1やIRF4、RALDH2に対するAhR の抑制を解除するためだと示唆されました。さらに、ケンフェロールやAhRアンタゴニスト化合物は、樹状細胞の RALDH2活性上昇を介して制御性T細胞誘導を促進することを、細胞、マウス個体レベルで確認しました。食物アレルギーモデルマウスを用いた実験も行い、ケンフェロールが実際に抗アレルギー作用を有することも確認しました(図1右)。西山教授らのグループでは、アレルギー症状を誘発するマスト細胞のはたらきに対してケンフェロールが抑制効果を示すことやその分子機構についても報告しており(※4)、ケンフェロールが様々な免疫反応に作用する結果、抗アレルギー作用を発揮することが考えられます。
※4 「ケンフェロールがマスト細胞活性化を抑制する分子機構」
https://www.mdpi.com/1422-0067/24/6/5997
研究を行った西山教授は、「今回の研究ではケンフェロールを選別しましたが、スクリーニングの結果から、フラボノイド類全般に類似の活性があることが示唆されました。フラボノイド類は一般的な食品物質ですので、日々の食生活に取り入れることで、自己免疫疾患などを抑制できる可能性があります。今後も、私たちが日常的に口にする食事の内容が、免疫細胞の働きに与える影響を、個体、細胞、遺伝子レベルで詳しく解析することを通じて、食事条件が病気の予防や緩和につながることを、一貫して発信していきたいと考えています」と、今後の研究の抱負を語っています。
本研究は、JSPS科研費(23K26860、23H02167、20H02939 、24K17872、21J12113)、日本免疫学会の若手免疫学研究推進事業、東京理科大学の特定研究推進費、飯島藤十郎記念食品科学振興財団、三島海雲記念財団の学術研究奨励金、武田科学振興財団の生命科学研究助成を受けて実施したものです。
【用語】
*1 樹状細胞
骨髄由来の白血球であり、樹状突起を持つ。外部からの異物を認識して取り込んだ後、リンパ球であるT細胞に情報伝達を行う。
*2 芳香族炭化水素受容体(AhR)
内分泌撹乱物質であるダイオキシン類や多環芳香族炭化水素類の受容体として働く転写因子。
*3 ナイーブCD4陽性T細胞
まだ抗原に晒されたことのないT細胞のうち、CD4陽性のもの。CD4は細胞表面に存在する糖タンパク質で、抗原提示細胞とやりとりをする際の補助受容体として働く。
*4 Foxp3陽性細胞
Foxp3は制御性T細胞のマスター転写因子。制御性T細胞の分化・機能発現などの重要な役割を担い、Tregにほぼ特異的に発現する。
【論文情報】
雑誌名:Allergy
論文タイトル:Kaempferol exerts anti-inflammatory effects by accelerating Treg development via Aryl hydrocarbon receptor-mediated and PU.1/IRF4-dependent transactivation of the Aldh1a2/Raldh2 gene in dendritic cells
著者:Miki Takahashi, Kazuki Nagata, Yumi Watanuki, Masaki Yamaguchi, Kenta Ishii, Tomohiro Harada, Natsuki Minamikawa, Mayuka Katagiri, Weiting Zhao, Naoto Ito, Takuya Yashiro, and Chiharu Nishiyama
発表者
高橋 美貴* 東京理科大学 先進工学部 西山研究室 修士課程修了(2023年度修士修了)
長田 和樹* 東京理科大学 先進工学部 西山研究室 助教
綿貫 優実* 東京理科大学 先進工学部 西山研究室 修士課程修了(2019年度修士修了)
山口 昌樹 東京理科大学 先進工学部 西山研究室 修士課程修了(2016年度修士修了)
石井 健大 東京理科大学 先進工学部 西山研究室 修士課程2年
原田 智裕 東京理科大学 先進工学部 西山研究室 修士課程1年
南川 夏己 東京理科大学 先進工学部 西山研究室 修士課程修了(2023年度修士修了)
片桐 万由佳 東京理科大学 先進工学部 西山研究室 修士課程修了(2023年度修士修了)
趙 維霆 東京理科大学 先進工学部 西山研究室 博士課程2年
伊藤 直人 東京理科大学 先進工学部 西山研究室 博士課程3年
八代 拓也 東京理科大学 先進工学部 西山研究室 講師(当時)
西山 千春 東京理科大学 先進工学部 西山研究室 教授
*筆頭著者
※PR TIMESのシステムでは上付き・下付き文字や特殊文字等を使用できないため、正式な表記と異なる場合がございますのでご留意ください。正式な表記は、東京理科大学WEBページ(https://www.tus.ac.jp/today/archive/20241216_1429.html)をご参照ください。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
